Príklad reaktívnych materiálov
Chémia / / July 04, 2021
The Reaktívne materiály sú látky, ktoré majú pri kontakte s inými sklonmi spustiť chemickú reakciu. Na konci tejto reakcie vznikne určité množstvo rôznych látok.
Reaktivita v látkach
The Reaktivita je kapacita látok komunikovať s ostatnými pri chemickej reakcii. Všetci účastníci tejto reakcie sa budú nazývať Reaktívni. Keď chemický jav skončí, nazývajú sa rôzne látky Produkty.
V priemyselnom prostredí sa reaktivita používa, keď chcete generovať množstvo produktu chcel. V priemyselných podnikoch sa robí to, že sa vyberie surovina, ktorá má vo svojom zložení príslušné reagencie, a to sa umiestni v nádobe s názvom Reaktor, aby prebehla chemická reakcia, a uistite sa, že existuje ekonomický proces a efektívne.
Sú chvíle, kedy reakcia bude to spontánne, a bude prebiehať bez námahy, iba kontaktom činidiel. Reagenty by bolo potrebné iba pretrepať, aby sa podporilo ich zabudovanie.
Pri iných príležitostiach nebude stačiť jednoduchý kontakt činidiel, ale bude potrebné upraviť podmienky procesu, buď pridaním ďalšieho miešania do reaktora, alebo zavedením ohrevu alebo dokonca ochladenia, aby reakcia prebiehala a prebiehala s lepšou rýchlosťou a výťažkom.
Reagenty sa začnú podieľať na generovaní Produktov, ale budú podľa pomeru ktorá označuje rovnicu, ktorá vyjadruje reakciu, ako je uvedené v nasledujúcom:
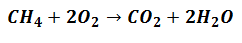
To znamená, že metánové činidlá (CH4) a kyslík (O.2) budú zmiešané v pomere 1 až 2 molekulárne jednotky na vytvorenie zodpovedajúcich produktov.
Ak je pridané jedno z reagencií najmenšie množstvo ktorý sa vyžaduje ako vypočítaný, sa bude volať Obmedzujúce činidlo, pretože keď sa všetko spotrebuje, reakcia sa zastaví.
Druhá reagencia, ktorej na konci reakcie bude prebytok, sa bude volať Reaktívne v nadmernom množstvea samozrejme bude dodávaný spolu s Produktmi.
Reaktivita látok môže byť použitá pri mnohých chemických javoch, ako napr Oxidácie, v prípade manganistanu draselného; Katalýza, ako v prípade platinového kovu s jemnou sieťovinou; elementárne výmeny, ako v prípade kovového zinku, ktorý nahrádza vodík v kyselinách.
Reaktivita ako vlastnosť nebezpečných materiálov
The Reaktivita predstavuje a rizikový majetok keď je reaktívny materiál už odpad bez použitia, tak sa najskôr naleje do nádoby, ktorá zaisťuje, že zostane izolovaný od ľudského kontaktu. Ak je odpad tuhý alebo tekutý, zvyčajne ide o silné plastové nádoby, ktoré sú povinne opatrené štítkom s piktogram „reagenčného materiálu“, čo je obrázok s oranžovým pozadím a zodpovedajúcou symbolikou v čiernej farbe. Nasledujúci obrázok zobrazuje rôzne signály pre rôzne typy reaktivity.

Jednou z vlastností je reaktivita CRETIB nebezpečného odpadu: Žieravý, reaktívny, výbušný, toxický, horľavý a biologicky infekčný. V skutočnosti je to najreprezentatívnejšie, pretože všetky ostatné vlastnosti súvisia so spôsobom reaktivity.
Veľmi častým prípadom, v ktorom je vystavené nebezpečenstvo týchto materiálov, je ich rozliatie. Napríklad, keď dôjde k úniku kyseliny sírovej a rozšíri sa na veľmi veľkú plochu, mali by ste byť odstránení pracovníci, ktorí nemajú školenie na riadenie situácie. Ľudia školení v tejto oblasti musia zasiahnuť.
Postup na odstránenie nebezpečnej situácie sa začína tým, že sa na miesto prejde s vhodnými osobnými ochrannými prostriedkami. Identifikujte a izolujte oblasť úniku reaktívneho materiálu a začnite pôsobiť proti svojej reaktivite s inými chemicky odlišnými druhmi. V tomto prípade kyselina sírová pôsobí ako kyselina. Túto reaktivitu bude možné uhasiť iba druhmi, ako je hydroxid sodný, jedna z najsilnejších báz.
Reakcia medzi kyselinou a zásadou sa nazýva neutralizácia. Pomocou tohto javu bude reaktivita kyseliny sírovej v úniku smerovaná k aktivite hydroxidu sodného.
Príde čas, keď hydroxid sodný, tiež reaktívny materiál, ukončí nebezpečnosť kyseliny sírovej. Po ukončení reakcie bude stačiť iba zriedenie produktov veľkým množstvom vody.

Príklady reaktívnych materiálov
- Hydroxid sodný
- Hydroxid vápenatý
- Hydroxid horečnatý
- Kyselina sírová
- Kyselina chlorovodíková
- Kyselina dusičná
- Sírovodík
- Dusičnan draselný
- Hydrogenuhličitan sodný
- Oxid uhličitý
- Oxid siričitý
- Oxid siričitý
- Plynný vodík
- Plynný kyslík
- Chlórový plyn
- Plynný bróm
- Kovové lítium
- Kovový sodík
- Kovové cézium
- Kovový horčík
- Dusičnan amónny
- Chlorid sodný
- Chlorid draselný
- Chlorid vápenatý
- Manganistan draselný
- Manganistan sodný
- Kovová platina
- Kovový zinok
- Karbid vápnika
- Acetylén
- Metán
- Ethane
- Propán
- Bután