Príklad organickej chémie
Chémia / / July 04, 2021
The Organická chémia Je súčasťou všeobecnej chémie zodpovednej za štúdium a funkčnú klasifikáciu chemických zlúčenín, ktorých štruktúrnym prvkom je Uhlík, prítomný v hojnom počte v živá hmota; Tak vzniká veľmi diferencovaný vesmír anorganickej chémie venovaný chemickým zlúčeninám klasifikovaným ako minerály.
Atóm uhlíka má v poslednej škrupine svojej elektronickej konfigurácie štyri elektróny. Táto vlastnosť spolu s atómovým polomerom umožňuje, aby bola kovalentnými väzbami spojená s inými atómy toho istého prvku v mnohých reťazcoch, ktoré vytvárajú veľkú rozmanitosť chemických zlúčenín stabilný.
Môžete skontrolovať Kovalentné väzby.
Takéto chemické zlúčeniny okrem atómov uhlíka, ktoré im dávajú svoju prvotnú štruktúru, obsahujú atómy vodíka ako hlavný doplnok uhlíkovej valencie. Navyše v tejto rozmanitosti zlúčenín existujú také, ktoré zasahujú atómy kyslíka, Dusík, halogény, síra a dokonca aj fosfor, prvky alkalických kovov a kovov alkalických zemín a kovy z prechod. Podľa toho, kto je do molekuly zapojený, budú to fyzikálne a chemické vlastnosti konečnej látky.
The Organické zlúčeniny sú prítomné po celom svete živá hmota; podporovať a udržiavať všetkých biologické funkcie, na rozdiel od anorganických alebo minerálnych látok, ktoré ľudia používali na komerčné účely, na experimentovanie alebo na plnenie určitých domácich úloh.
Dejiny organickej chémie
Pred rokom 1828 sa už rozlišovalo medzi organickou chémiou a anorganickou chémiou. Organická hmota bola spojená s výtvorom prostredníctvom a „vitálna sila“a na anorganické s neživými, s minerálmi. Vzhľadom na tieto koncepcie nebolo možné očakávať, že v laboratóriu získame organické zlúčeniny z anorganických materiálov.
Avšak v roku 1828 Friedrich Wöhler (1800-1882) sa podarilo pripraviť organickú látku, Močovina CO (NH2)2, dôležitý produkt živočíšneho metabolizmu, z anorganických zlúčenín. Liečba Olovo kyanát Pb (CNO)2 s Amoniak NH3 získať Kyanát amónny NH4CNO; Táto zlúčenina sa skutočne vytvorila, ale keď sa roztok varil, aby vykryštalizoval kyanát amónny, transformoval sa na močovinu.
Táto chemická zmena je príkladom Interné preskupenie, v ktorom sa nemení počet alebo trieda atómov v molekule, ale iba ich poradie v rámci nej. Tieto typy transformácií sú v organickej chémii veľmi bežné.
Wöhlerov objav neskôr inicioval opustenie teórie životných síl úplne zlikvidovaný, po ktorom bude nasledovať príprava mnohých ďalších organických zlúčenín v laboratórium. Napriek tomu existujú kvalifikátory anorganických a organických, pretože anorganické zlúčeniny súvisia s minerálnymi produktmi a organické zlúčeniny, ktoré sú vlastne zlúčeninami uhlíka a vodíka a ich deriváty, sú typu produkovaného živými organizmami.
Aj keď zákony všeobecnej chémie platia rovnako pre obidve zlúčeniny, rôzne príčiny toto rozdelenie odôvodňujú a robia ho nevyhnutným. Organické a anorganické zlúčeniny sa teda líšia rôznymi vlastnosťami, napríklad: ich Rozpustnosť výhodné v organických rozpúšťadlách (éter, alkohol, chloroform atď.) a vo vode Stabilita (organické zlúčeniny sa rozkladajú pri relatívne nízkych teplotách) a Povaha reakcií; pre anorganické zlúčeniny sú iónové, jednoduché a prakticky okamžité a pre organické zlúčeniny sú kovalentné, komplexné a pomalé.
Organické zlúčeniny
Známe sú uhlíkové zlúčeniny s reťazcami až do deväťdesiatich atómov. The reťaze Atómy uhlíka môžu byť lineárne a rozvetvené a majú jednoduché kovalentné väzby alebo majú dvojité alebo trojité väzby. Je známe, že viac ako 2 500 zlúčenín obsahuje iba uhlík a vodík (Uhľovodíky).
Izoméria organických zlúčenín
V anorganických zlúčeninách vzorec všeobecne predstavuje jednu zlúčeninu; teda existuje iba jedna látka vzorca H2SW4. Molekula kyseliny sírovej obsahuje dva atómy vodíka, jeden zo síry a štyri z kyslíka, v špecifickom a jedinečnom usporiadaní. V organických zlúčeninách to je zriedka sa to stane. Existujú napríklad dve zlúčeniny, ktoré reagujú na vzorec C.2H6Alebo etylalkohol alebo etanol a dimetyléter.

Čím je molekula zložitejšia, to znamená, že čím väčší je počet atómov uhlíka, tým väčší je počet možných izomérov.
Analýza organických zlúčenín
Analýza organickej zlúčeniny zahrnuje: kvalitatívna analýza, kvantitatívna analýza a Funkčná analýza. V prípade, že sa zlúčenina nachádza v nečistom stave, je predtým purifikovaná Kryštalizácia, Destilácia, Sublimácia, Extrakcia, atď. Kritérium čistoty možno posúdiť na základe jeho fyzikálnych konštánt, ako je teplota topenia, teplota varu, hustota, rozpustnosť, kryštalická forma, index lomu atď.
The kvalitatívna analýza Overuje sa to vyšetrením na prítomnosť prvkov tvoriacich zlúčeninu, najmä uhlíka, vodíka a dusíka, niekedy aj halogénov, síry a fosforu.
The kvantitatívna analýza Vykonáva sa s použitím metód použitých pri kvalitatívnej analýze. Východiskovým bodom je určité množstvo látky, ktorá podlieha spaľovaniu, a oxid uhličitý sa zhromažďuje a odváži. - uhlík a vodná para, ktoré sa vytvorili na výpočet percenta uhlíka a vodíka v zlúčenina. Výsledky kvantitatívnej analýzy uľahčujú výpočet empirický vzorec, hoci molekulárny vzorec je možné nájsť až po určení molekulovej hmotnosti látky. Problém však ešte nie je vyriešený, pretože rovnaký molekulárny vzorec môže zodpovedať rôznym izomérom.
Klasifikácia organických zlúčenín
Podľa ich štruktúry sa organické zlúčeniny delia na zlúčeniny alifatický, aromatický Y. heterocyklický. Alifatické zlúčeniny sú príbuzné metánu CH4, sú otvoreného reťazca, okrem cykloparafínov, a za svoj názov vďačia skutočnosti, že do tejto skupiny patria živočíšne a rastlinné tuky.
The aromatické zlúčeniny, uzavretý reťazec, úzko súvisiaci s benzénom, C.6H6, a za svoje meno vďačia skutočnosti, že mnohé z nich majú voňavé, príjemné vône.
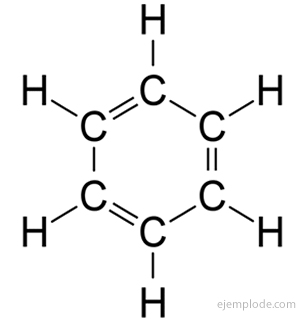
Benzénový kruh
The heterocyklické zlúčeniny Sú to zlúčeniny s uzavretým reťazcom, v ktorých je v kruhu iný prvok ako uhlík.
Podľa svojej ústavy sú to:
Uhľovodíky, ktorá je zase vzhľadom na typ odkazov, ktoré má, klasifikovaná ako Alkány, Alkenes Y. Alkyny. Okrem toho do tejto kategórie patria cykloalkány, benzén a ich deriváty, ktoré pozostávajú iba z uhlíka a vodíka.
Heterocyklické zlúčeniny
Halogénované deriváty:R-X
Nitrozlúčeniny:R-NO2
Kyseliny sulfónové:R-SO3H
Nitrily (OR alkylkyanidy) a izonitrily:R-CN a R-NC. Líšia sa tým, ako je atóm dusíka viazaný v molekule.
Alkoholy:R-OH
Fenoly: Zlúčeniny na základnom reťazci pozostávajúcom z benzénového kruhu s pridanou hydroxylovou skupinou.

Étery:R-O-R
Merkaptány: R-SH
Tioétery:R-S-R
Tiokyseliny:R-COSH
Aldehydy:R-CHO
Ketóny:R-CO-R
Karboxylové kyseliny:R-COOH
Choď von:R-COOM (M pre kov)
Estery: R-COO-R
Anhydridy: R-CO-O-OC-R
Amíny:R-NH2, R-NH-R, 2R-N-R
Sacharidy typu Aldosa:-CHOH-CHOH-CHO
Sacharidy ketózového typu:-CHOH-CO-CH2Oh
Organokovové zlúčeniny:R-M-R
Metal-alkylhalogenidy:R-MX (tiež známe ako Grignardove činidlá)



