Príklad objemovej analýzy
Chémia / / July 04, 2021
On Analytická chémia, Volumetria je analytická metóda, ktorá pozostáva z Meranie objemu činidla potrebného na stechiometrickú reakciu s analytom, čo je látka, ktorá sa má určiť.
Reagujte stechiometricky sa vzťahuje na látky chemicky interagujúce podľa podiel, ktorý označuje chemickú rovnicu už vyvážený.
Látka, ktorá sa má skúmať, sa volá Analyt. Z tejto látky sa odoberie známy a presne odmeraný objem ako vzorka, ktorú budeme nazývať Alikvotne, obsiahnutý v Erlenmeyerovej banke na začatie analýzy.
Koncepty volumetrickej analýzy
Volumetrická analýza, ktorá je typom Chemický rozbor, nosiť zahŕňal chemickú reakciu. Táto chemická reakcia sa uskutoční medzi vzorkou s neznámym množstvom skúmanej látky a známym množstvom inej látky, ktorá je schopná reagovať s prvou z nich.
The Reakčné látky budú vo vodnom roztokua budú sa merať objemy roztokov, ktoré interagovali s cieľom dosiahnuť koniec reakcie, čo bude viditeľné vďaka indikátoru, ktorý zafarbí vnútri banky.
Pri volumetrickej analýze bol vodný roztok zlúčeniny
Známa koncentrácia sa nazýva štandardné riešenie, Standard alebo Titrant, a bude slúžiť ako referencia pre ukončenie reakcie pri výpočte, ktorý odhalí množstvo skúmanej látky.Tento postup reakcie oboch riešení sa nazýva Chemický stupeň o Oceňovanie, ktoré je základnou súčasťou volumetrickej analýzy. Pozostáva z chodenia postupne nalievaním Štandardného riešenia (Titrant) v alikvotnej časti (Ukážka), kým indikátor neukáže zmenu s farebným rozdielom.
A Ukazovateľ Je to chemická látka, ktorá sa pridáva do alikvotnej časti a vykazuje sfarbenie a ktorá po ukončení reakcie zmení farbu.
Volumetrická analýza pozostáva z jednoduchej série krokov:
1. - Príprava štandardného roztoku
2. - Príprava vzorky alebo alikvotnej časti
3. - Chemický stupeň
4. - Meranie objemu
5. - Výpočet skúmanej látky.
Až do bodu, keď už majú úplne reagoval týchto dvoch látok, nazýva sa to Bod rovnocennosti.
Rovnako ako v každej chemickej analytickej metóde, aj v objemovej analýze existujú požiadavky na dobré výsledky:
- Chemická reakcia musí byť SelektívneTo znamená, že štandardné riešenie bude reagovať iba so vzorkou.
- Chemická reakcia musí byť Stechiometrický, to znamená, podriaďovať sa pomerom vyznačeným vo vyváženej chemickej rovnici.
- Chemická reakcia musí byť Kvantitatívne; označuje 99,9% dokončenie v bode ekvivalencie.
-Musí byť zistiteľný konečný bod reakcie, čo lepšie potvrdí indikátor.
Primárny vzor
The Primárne vzory Sú to látky vysokej čistoty, ktorých koncentrácia v roztoku sa počíta priamo z odváženého množstva a použitého objemu vody.
A) Áno, možno reagovať pracovnými riešeniami, poznať ich koncentrácie a prevádzať ich na štandardné roztoky.
Príklady primárnych vzorov sú:
- uhličitan sodný (Na2CO3): Používa sa na štandardizáciu kyselín, ako je kyselina sírová.
- Bftalát draselný: Primárnym štandardom je príprava štandardných roztokov zásad, ako je hydroxid sodný.
Chlorid sodný (NaCl): Používa sa na štandardizáciu roztokov dusičnanu strieborného.
- Uhličitan vápenatý (CaCO3): Primárny štandard pre EDTA (kyselina etyléndiamíntetraoctová).
Primárny vzor musí spĺňať niekoľko základných charakteristík:
Musí mať Vysoká čistota, Stabilita v atmosfére, Absencia hydratačnej vody, Nízke náklady a ľahké získanie, Y Vysoká ekvivalentná hmotnosť.
Klasifikácia objemovej analýzy
V závislosti od chemických druhov, s ktorými pracujete na analýze, bude to typ volumetrie:
Acidobázická volumetria: Funguje buď s kyselinou alebo s bázou na analýzu vzoriek, ktoré obsahujú kyseliny alebo zásady.
Objem zrážok: Tiež sa nazýva Argentometria a na stanovenie počtu chloridov vo vzorke používa štandardný roztok dusičnanu strieborného.
Objemová zložitosť: Na meranie koncentrácie tvrdosti, tj. Uhličitanu vápenatého a horečnatého, vo vode sa používa štandardný roztok komplexotvorného činidla, ako je EDTA.
Volumetria REDOX: Reakcia prebieha medzi oxidujúcou látkou a redukčnou látkou.
Ukazovatele
Z mnohých ukazovateľov používaných v odbore volumetrie vynikajú tri:
1.- Metyl oranžová: V alikvotnej časti je potrebné oranžové sfarbenie, ktoré sa bude titrovať kyselinou. Po dosiahnutí bodu ekvivalencie indikátor zožltne.
2.- Fenolftaleín: Je to na začiatku priehľadné v alikvotnej časti, ktorá bude mať názov so základňou. Keď sa dosiahne bod ekvivalencie, indikátor sa zmení na ružový.
3.- Eriochrómová čierna: Je to indikátor používaný na stanovenie tvrdosti vody. Na začiatku je v alikvotnej časti fialová, až kým nie je titrovaná komplexotvorným činidlom. Na konci reakcie sa zmení na modrú.

Prístroje v objemovej analýze
V objemovej analýze sa použije séria nástrojov, ktoré, ak nie sú k dispozícii, nie je možné adekvátne vyvinúť:
1. - Odmerná banka: Je to nádoba ako žiarovka v dolnej časti, sploštená dole, ktorá má tenký stĺpec, do ktorého sa pridáva kvapalina. Má značku, ktorá označuje, kde by mal byť meniskus kvapaliny, aby zakryl presný objem. Používa sa na to, aby obsahoval štandardné roztoky; vďaka presnosti jeho objemu je zabezpečená známa koncentrácia.

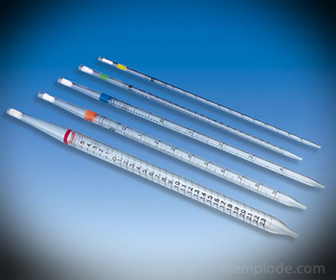
2. - Pipety: Sú to delené tenké trubice, ktoré umožňujú spoľahlivo odmerať presné množstvo kvapaliny. Sú k dispozícii do 25 mililitrov a umožňujú presný odber vzoriek.
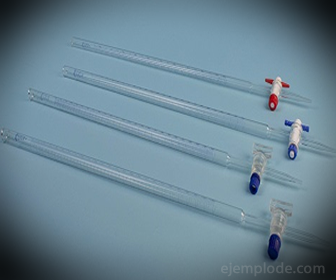
3. - Byreta: Je to podlhovastá trubica s objemom 50 mililitrov, ktorá bude obsahovať štandardné riešenie. Na jednom zo svojich koncov má ventil na reguláciu prietoku, ktorý vypúšťa roztok do alikvotnej časti.
4. - Erlenmeyerove banky: Sú to nádoby s plochým dnom, kužeľovitého tvaru, ktoré končí valcovým okrajom. Táto konštrukcia ich robí vhodnými na chemické titrácie, pretože neumožňujú pretrepávanie roztokov, aby ich pretiekli. Aby sa zabezpečil spoľahlivý výsledok, budú potrebné minimálne tri, ak sa majú vykonať opakované skúšky.

Výpočty v objemovej analýze
Pri manipulácii s vodnými roztokmi sú dôležitými množstvami pre volumetrickú analýzu koncentrácia a objem.
Hlavná rovnica volumetrie je založená na štyroch hlavných údajoch:
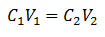
C.1= Koncentrácia vzorky (neznáma)
V.1= Objem alikvotnej časti, s ktorým sa pracovalo na analýze
C.2= Koncentrácia štandardného roztoku použitého na dosiahnutie bodu ekvivalencie
V.2= Na dosiahnutie reakcie je potrebné objemové štandardné riešenie
Údaje sú nahradené v rovnici, iba neznáma je koncentrácia. Všetky údaje samozrejme musia byť na rovnakých jednotkách.
Príklady objemovej analýzy
Stanovenie chloridov (Cl-) argometometriou s dusičnanom strieborným.
Stanovenie bromidov (Br-) argometometriou s dusičnanom strieborným.
Stanovenie kyanidov (CN-) argentometriou s dusičnanom strieborným.
Stanovenie uhličitanu horečnatého (MgCO3), pomocou komplexometrie, s EDTA.
Stanovenie uhličitanu vápenatého (CaCO3), pomocou komplexometrie, s EDTA.
Analýza kyseliny sírovej (H2SW4) s hydroxidom sodným (NaOH).
Analýza hydroxidu sodného (NaOH) s kyselinou chlorovodíkovou (HCl).
Stanovenie antimónu (III) manganistanom draselným (KMnO4).
Stanovenie arzénu (III) manganistanom draselným (KMnO4).
Stanovenie titánu (III) manganistanom draselným (KMnO4).
Stanovenie molybdénu (III) pomocou manganistanu draselného (KMnO4).
Stanovenie železa (II) manganistanom draselným (KMnO4).
Stanovenie oxalátového iónu pomocou manganistanu draselného (KMnO4).