100 Primeri atomov
Miscellanea / / July 04, 2021
Z imenom atom najmanjša enota, ki tvori zadeve in ki ima še vedno lastnosti kemični element ki ji pripada. Na primer: aluminij, železo, jod. Atom je osnovni delček vse znane snovi in je prisoten v vseh stvareh: v živa bitja in v neživih predmetih.
Atom je pogosto označen kot a nedeljiva enota, vendar to ni zaradi nezmožnosti delitve atoma, ampak v primeru deljenja bi izgubil kemijske lastnosti kemijskega elementa, ki mu pripada: atom v resnici sestavljajo še manjši delci: subatomski.
Sestava atoma
Dejansko je sestava atomov vključuje središče, sestavljeno iz jedra, ki vsebuje protone in nevtrone, in več plasti ali ravni energija okoli tega jedra, ki vsebuje najmanjše subatomske delce atomov, elektroni.
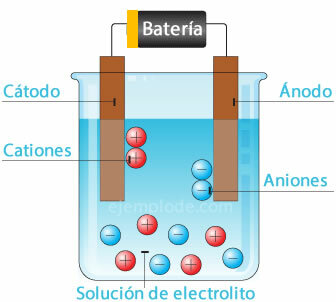
Medtem ko elektroni imajo negativni naboj, protoni imajo enak, a pozitiven električni naboj in nevtroni nimajo stroškov. Rutherford je predlagal enega od atomskih modelov, ki pojasnjuje obstoj pozitivnih nabojev v jedru atoma in negativnih nabojev v orbitah okoli njega. S tem modelom je bilo mogoče razložiti (čeprav z nekaterimi omejitvami) združitev atomov, ki se tvori kemične spojine.
Lastnosti atoma
Atom jih ima vedno nekaj lastnosti, ki so koristne za razumevanje načina njihove porazdelitve, ko tvorijo različne kemične spojine. Atom ima vedno atomsko številko (predstavljeno s črko Z), ki predstavlja število protonov v jedru, ki je enako številu elektronov, ki so v njem okoli. Ima tudi masno število, predstavljeno s črko A, ki se nanaša na vsoto protonov in nevtronov, ki jih atom vsebuje v svojem jedru.
Klasifikacija atomov
Obstajajo različni razredi kemičnih elementov. Najpogostejša razvrstitev je klasifikacija, izvedena v periodni sistem elementov, ki med drugimi lastnostmi organizira in razvrsti kemijske elemente glede na njihovo atomsko število.
Vsi atomi z enakim atomsko število pripadajo istemu kemičnemu elementu. Po drugi strani pa se atomi, ki imajo različne količine nevtronov, vendar enako število protonov (atomsko število), imenujejo izotopi. Na primer, vodik ima tri izotopi naravni atomi: protium 1H (s protonom v jedru in elektronom v njegovi orbiti), devterij 2H (s protonom in nevtronom v jedru in elektronom v njegovi orbiti) in tritij 3H (z enim protonom in dvema nevtronoma v jedru in enim elektronom v njegovi orbiti). Toda vsi trije izotopi pripadajo istemu kemičnemu elementu, vodiku.
Zgodovina atomske teorije
The atomska teorija, ki vključuje atome kot minimalno enoto zgradbe snovi, obstaja že od antične Grčije.
Leta 1803 je John Dalton je predlagal atomski model, ki je pokazal, da je zveza med atomi, ki tvori kemične spojine, potekala skozi določena določena razmerja vsakega od njih. John Thomson je s svoje strani določil pozitivni in negativni naboj ter konformacijo ioni obeh znakov. Naslednji, ki je predlagal atomski model, je bil Rutherford, ki je prvič definiral pozitivno atomsko jedro in orbite, kjer se nahajajo elektroni. Nato je Bohr predlagal model, ki pravi, da se elektroni ne nahajajo v vseh orbitah ali nivojih energije, ampak da obstajajo dovoljene in prepovedane ravni energije.
Modeli so si sledili do trenutnih študij Kvantna teorija, usmerjena predvsem na polja. Očitno je gotovo, da je zgradba atomskega jedra in delcev, ki ga sestavljajo, veliko bolj zapletena kot tradicionalna elektronska zgradba atomov.
Primeri atomov
Tu je seznam primerov kemičnih elementov v periodnem sistemu, za katere obstaja določeno število atomov, ki tvorijo njihove izotope:
| Aktinij (Ac) | Fluor (F) | Svinec (Pb) |
| Aluminij (Al) | Fosfor (P) | Plutonij (Pu) |
| Amerika (Am) | Francio (FR) | Polonij (Po) |
| Antimon (Sb) | Gadolinij (Gd) | Kalij (K) |
| Argon (Ar) | Galij (Ga) | Praseodim (Pr) |
| Arzen (kot) | Germanij (Ge) | Prometij (Pm) |
| Astato (pri) | Hafnij (Hf) | Protaktinij (Pa) |
| Žveplo (S) | Hassio (Hs) | Polmer (Ra) |
| Barij (ba) | Helij (He) | Radon (Rn) |
| Berilij (Be) | Vodik (H) | Renij (Re) |
| Berkelij (Bk) | Železo (Fe) | Rodij (Rh) |
| Bizmut (Bi) | Holmij (Ho) | Roentgenio (Rg) |
| Bohrio (Bh) | Indijski (v) | Rubidij (Rb) |
| Bor (B) | Iridij (Go) | Rutenij (ru) |
| Brom (br) | Kripton (kr) | Rutherfordio (Rf) |
| Kadmij (Cd) | Lanthanum (The) | Samarij (Sm) |
| Kalcij (Ca) | Lawrencio (Lr) | Seaborgio (Sg) |
| Kalifornij (prim.) | Litij (Li) | Selen (Se) |
| Ogljik (C) | Livermorio (Lv) | Silicij (si) |
| Cerij (Ce) | Lutecij (lu) | Natrij (Na) |
| Cezij (Cs) | Magnezij (Mg) | Talij (Tl) |
| Cink (Zn) | Mangan (Mn) | Tantal (ta) |
| Cirkonij (Zr) | Meitnerij (Mt) | Tehnecij (Tc) |
| Klor (Cl) | Mendelevij (Md) | Telur (Te) |
| Kobalt (co) | Živo srebro (Hg) | Terbij (Tb) |
| Baker (Cu) | Molibden (mo) | Titan (Ti) |
| Kopernik (Cn) | Neodim (Nd) | Torij (th) |
| Krom (Cr) | Neon (Ne) | Tulij (Tm) |
| Kurij (cm) | Neptunij (Np) | Oganeson (Og) |
| Darmstadcij (DS) | Niobij (Nb) | Moscovio (Mc) |
| Disprozij (Dy) | Nikelj (Ni) | Tenese (Ts) |
| Dubnium (Db) | Dušik (N) | Nihonij (Nh) |
| Einsteinij (Es) | Nobelio (ne) | Uran (U) |
| Erbij (Er) | Zlato (Au) | Vanadij (V) |
| Skandij (sc) | Osmij (os) | Volfram (W) |
| Kositer (sn) | Kisik (O) | Ksenon (Xe) |
| Stroncij (Sr) | Paladij (Pd) | Jod (I) |
| Europij (Eu) | Srebro (Ag) | Itterbij (Yb) |
| Fermij (Fm) | Platina (Pt) | Ytrio (Y) |
| Flerovio (Fl) |
Sledite z: