Definicija reakcijske hitrosti in kemijskega ravnovesja
Miscellanea / / December 14, 2021
Konceptualna opredelitev
Reakcija je v kemičnem ravnovesju, ko je hitrost prednje reakcije enaka hitrosti povratne reakcije.

Kemijski inženir
vse kemijska reakcija ima do njega določeno spontanost Ravnovesje, in da ga raziščemo, to storimo skozi znak ∆G, Energija Gibbsa prostega, kar pomeni, da lahko s pomočjo vrednosti te velikosti napovemo, ali se bo reakcija zgodila v določenem smislu ali ne.
Sprememba Gibbsove proste energije je na splošno izražena pod standardnimi pogoji kot razlika med energijami produktov in reaktantov tudi v standardnem stanju:
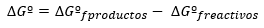
Če se reakcija zgodi pod nestandardnimi pogoji, je razmerje med ∆Gº in ∆G določeno z naslednjim: izražanje:
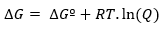
Kjer je Q reakcijski količnik.
Da bi razumeli pomen hitrost reakcije in kemično ravnotežje moramo preučiti predznak ∆G:
Če je ∆G negativen, to pomeni, da je reakcija spontana (pojavi se) v neposrednem pomenu.
Če je ∆G pozitiven, to pomeni, da reakcija ni spontana (ne nastopi) v neposrednem pomenu.
Medtem ko je ∆G = 0, spremembe ne bo, saj je sistem v ravnotežju in kot že omenjeno,
hitrost Hitrost neposredne reakcije je enaka hitrosti posredne reakcije. To pomeni, da je reakcijski kvocient Q enak ravnotežni konstanti K, zato ni težnje po favoriziranju določene smeri reakcije.Ker je Q definiran kot:
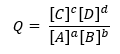
Za splošno reakcijo:
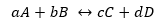
Medtem ko ima K isto obliko, vendar s koncentracijami v ravnotežju.
Če se vrnemo na primer, ko je ∆G negativen, to pomeni, da je reakcijski količnik Q manjši od K (konstanta ravnotežje), pomeni, da so koncentracije produkta nižje, kot bi morale biti, če bi bila reakcija v Ravnovesje. Zato v smislu spontanosti postane spontan v neposrednem pomenu.
Če je ∆G pozitiven, bo prišlo do prevlade produktov nad tistimi, ki bi morali obstajati, če bi bil sistem v ravnotežju, pri čemer je Q večji od K. Zato je reakcija spontana v obratni smeri.
Opozoriti je treba, da je stroga definicija Q in K podana v smislu aktivnosti produktov in reaktantov, pri čemer je aktivnost opredeljena v smislu koncentracije ali tlakov kot:
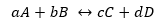
no dobro:
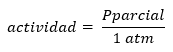
Od tam sledi, da sta Q in K brezdimenzionalna in ju je mogoče povečati tako v koncentracijah kot v parcialnih tlakih.
Ko so koncentracije ali delni tlaki produktov in reaktantov skozi čas konstantni, pride do situacije kemično ravnotežje, v kolikor je dosežena situacija dinamičnega ravnotežja, ker je hitrost neposredne in inverzne reakcije z identična. Pomembno je poudariti dinamičnost ravnotežja, hitrost, s katero se oblikujejo in poraba izdelkov in reagentov je enaka, zato koncentracije ali parcialni tlaki ne se razlikuje.
Če se pogoj odmakne od ravnotežne situacije, bo neka vrsta prevladala nad drugo in od tam nastane izraz, ki povezuje neposredno in inverzno hitrost reakcije, Kc:
Recimo, da je reakcija prikazana zgoraj:
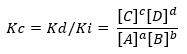
Kjer sta Kd in Ki konstanti reakcijske hitrosti v smeri naprej oziroma nazaj.
Če je Kc> 1, to pomeni, da je Ki manjši od Kd, zato obstaja visoka stopnja pretvorbe produktov v reaktante. V tem primeru se ravnotežje premakne proti produktom.
Obratno se zgodi, če je Kc <1, kar pomeni, da je neposredna reakcijska hitrost manjša od posredne reakcijske hitrosti in je malo porabe reaktantov se ravnotežje premakne proti reaktantom. Medtem ko je Kc = 1, so hitrosti enake in sistem je v ravnotežju. Pomembno je opredeliti dve vprašanji: prvič, vrednost te konstante je odvisna izključno od temperaturo in se posledično spreminja glede na velikost, uporabljeno za izražanje koncentracij ali tlakov produktov in reaktantov. Končno, zakon Kemično ravnotežje se prilagodi razredčenju raztopin ali plinov pod nizkim tlakom.
Teme iz Stopnje reakcije in kemijskega ravnovesja