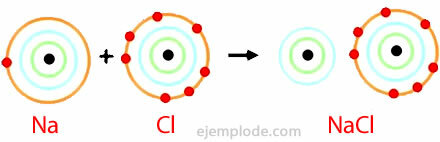
Primer ionske vezi
Kemija / / July 04, 2021
Jonsko vez daje prisotnost kationov in anionov, kemičnih vrst z električnimi naboji nasprotnih znakov. Opredeljen je kot elektrostatična sila, ki veže ione v ionski spojini.
Atomi elementov z nizko energijo ionizacije ponavadi tvorijo katione. Nasprotno pa tisti z visoko afiniteto do elektronov ponavadi tvorijo anione.
Alkalne in zemeljskoalkalijske kovine pogosteje tvorijo kation v ionskih spojinah, halogeni in kisik pa najverjetneje tvorijo anione. Posledično je sestava najrazličnejših ionskih spojin posledica kombinacije kovine skupine IA ali IIA in halogena ali kisika.
Na primer, pri reakciji med litijem in fluorom nastane litijev fluorid, strupeno bel prah, ki se uporablja za znižanje tališča spajke in pri izdelavi keramike. Elektronska konfiguracija litija je 1s2, 2 s1, in ta fluor je 1s2, 2 s2, 2 str5. Ko ti atomi pridejo v stik, valentni elektron 2s1 Litij se prenese v atom fluora.
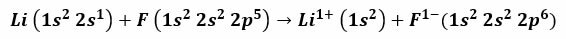
Velja domnevati, da se postopek začne z odklopom litijevega elektrona, ki ga ionizira, da doseže pozitivno valenco 1+. Nadaljuje se s sprejemom tega elektrona s strani fluora, kar mu daje negativni naboj. Na koncu nastane ionska vez z elektrostatičnim privlačenjem. Spojina litijevega fluorida bo električno nevtralna.
Številne pogoste reakcije vodijo do tvorbe ionskih vezi. Na primer, pri izgorevanju kalcija v kisiku nastane kalcijev oksid:
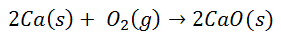
Dvoatomska molekula kisika se loči na dva posamezna atoma. Potem bo prišlo do prenosa dveh elektronov iz atoma kalcija v vsak atom kisika. Nato bosta oba imela svoja naboja: za kalcij 2+ za vsak atom in za kisik 2 za vsak atom. Po končni vezavi je molekula kalcijevega oksida električno nevtralna.
Rešetkasta energija ionskih spojin
Z vrednostmi ionizacijske energije in afiniteto elektronov elementov je mogoče predvideti, kaj elementi tvorijo ionske spojine, vendar je treba oceniti tudi stabilnost te vrste spojine.
Ionizacijska energija in afiniteta elektronov sta opredeljeni za procese, ki se pojavijo v plinski fazi, čeprav so vse ionske spojine trdne pri 1 atmosferi tlaka in 25 ° C. Trdno stanje je zelo različno stanje, ker je vsak kation obdan z določenim številom anionov in obratno. Posledično je celotna stabilnost trdne ionske spojine odvisna od interakcij vseh ionov in ne le od interakcije kationa z anionom.
Kvantitativno merilo stabilnosti katere koli ionske trdne snovi je njeno mrežasta energija, ki je opredeljeno kot Energija, potrebna za popolno ločevanje mola trdne ionske spojine na njene ione v plinastem stanju.
Born-Haberjev cikel za določanje rešetkaste energije
Energije mreže ni mogoče izmeriti neposredno. Če pa sta struktura in sestava ionske spojine znana, je izvedljivo izračunati njeno mrežno energijo z uporabo Coulombovega zakona, ki navaja, da je potencialna energija med dvema ionoma sorazmerna zmnožku njihovih nabojev in obratno sorazmerna z razdaljo med njima. Ustaviti.
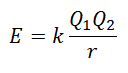
Ker je naboj kationa pozitiven, naboj aniona pa negativen, bo izdelek v energiji dobil negativen rezultat. To predstavlja eksotermno reakcijo. Posledično je za dovajanje procesa potrebno dovajanje energije.
Prav tako je možno posredno določiti energijo mreže, če se domneva, da ionska spojina nastaja v več fazah. Ta postopek je znan kot Born-Haberjev cikel, ki povezuje mrežne energije ionskih spojin z ionizacijskimi energijami, elektronsko afiniteto in drugimi atomskimi in molekularnimi lastnostmi. Ta metoda temelji na Hess-ovem zakonu algebraične vsote kemijskih reakcij, razvila pa sta jo Max Born in Fritz Haber. Born-Haberjev cikel opredeljuje različne faze, ki so pred tvorbo ionske trdne snovi.

Natrijev klorid
Natrijev klorid je ionska spojina s tališčem 801 ° C, ki prevaja elektriko v staljenem stanju in v vodni raztopini. Kamena sol je eden od virov natrijevega klorida in jo najdemo v podzemnih nahajališčih, ki so pogosto debela nekaj sto metrov. Natrijev klorid dobimo tudi iz morske vode ali slanice (koncentrirana raztopina NaCl) s sončnim izhlapevanjem. V naravi ga najdemo tudi v mineralu Halite.

Natrijev klorid se uporablja več kot kateri koli drug material pri izdelavi anorganskih kemičnih spojin. Svetovna poraba te snovi znaša približno 150 milijonov ton na leto. Natrijev klorid se uporablja predvsem za proizvodnjo drugih anorganskih kemičnih spojin, kot so klorov plin, natrijev hidroksid, kovinski natrij, vodikov plin in natrijev karbonat. Uporablja se tudi za taljenje ledu in snega na avtocestah in cestah.