Primer organske kemije
Kemija / / July 04, 2021
The Organska kemija Je del splošne kemije, zadolžen za študij in funkcionalno klasifikacijo kemičnih spojin, katerih strukturni element je Ogljik, prisotnih v izobilju v živa snov; tako nastane dobro diferencirano vesolje anorganske kemije, posvečeno kemijskim spojinam, razvrščenim kot minerali.
Atom ogljika ima v zadnji lupini svoje elektronske konfiguracije štiri elektrone. Ta lastnost skupaj z značilnostjo atomskega polmera omogoča, da se s kovalentnimi vezmi poveže z drugimi atomi istega elementa v številnih verigah tvorijo veliko raznolikost kemičnih spojin stabilno.
Lahko preverite Kovalentne vezi.
Takšne kemične spojine poleg ogljikovih atomov, ki jim dajejo prvotno zgradbo, vsebujejo atome vodika kot glavno dopolnilo ogljikovi valenci. Poleg tega v tej raznolikosti spojin obstajajo tudi tiste z intervencijo atomov kisika, Dušik, halogeni, žveplo in celo fosfor, alkalijski in zemeljskoalkalijski elementi ter kovine prehod. Glede na to, kdo je vpleten v molekulo, bodo odvisne fizikalne in kemijske lastnosti končne snovi.
The organske spojine so prisotni v celotnem živa snov; spodbujati in vzdrževati vse biološke funkcijeza razliko od anorganskih ali mineralnih snovi, ki so jih ljudje uporabljali v komercialne namene, za eksperimentiranje ali za izpolnjevanje nekaterih domačih nalog.
Zgodovina organske kemije
Pred letom 1828 so že razlikovali med organsko kemijo in anorgansko kemijo. Organska snov je bila povezana z ustvarjanjem skozi "vitalna sila", in anorganskemu z neživim, z mineralom. Glede na te koncepte ni bilo mogoče pričakovati, da bi v laboratoriju pridobivali organske spojine iz anorganskih materialov.
Vendar leta 1828 Friedrich Wöhler (1800-1882) uspelo pripraviti organsko snov, Sečnina CO (NH2)2, pomemben produkt presnove živali iz anorganskih spojin. Zdravljenje Svinčev cianat Pb (CNO)2 s Amoniak NH3 dobiti Amonijev cianat NH4CNO; Ta spojina je resnično nastala, a ko je raztopina zavrela, da je kristalizirala amonijev cianat, se je preoblikovala v sečnino.
Ta kemična sprememba je primer Notranja prerazporeditev, pri katerem se število ali razred atomov v molekuli ne spremeni, temveč le njihov vrstni red v njej. Te vrste transformacij so zelo pogoste v organski kemiji.
Wöhlerjevo odkritje je pozneje sprožilo opustitev teorije življenjske sile popolnoma zavrženo, čemur sledi priprava številnih drugih organskih spojin v laboratorij. Kljub temu obstajajo lastnosti anorganskega in organskega, saj so anorganske spojine povezane z mineralnimi proizvodi in organske spojine, ki so dejansko spojine ogljika in vodika in njihovi derivati, so tiste vrste, ki jih proizvajajo živi organizmi.
Čeprav zakoni splošne kemije enako veljajo za obe spojini, različni vzroki upravičujejo in zahtevajo to delitev. Tako se organske in anorganske spojine razlikujejo po različnih lastnostih, kot so: njihove Topnost prednostno v organskih topilih (eter, alkohol, kloroform itd.) in v vodi Stabilnost (organske spojine se razgradijo pri razmeroma nizkih temperaturah) in Narava reakcij; za anorganske spojine so ionske, enostavne in praktično trenutne, za organske pa kovalentne, kompleksne in počasne.
Organske spojine
Znane so ogljikove spojine z verigami do devetdeset atomov. The verige Atomi ogljika so lahko linearno in razvejano in imajo enojne kovalentne vezi ali imajo dvojne ali trojne vezi. Znano je, da več kot 2500 spojin vsebuje samo ogljik in vodik (Ogljikovodiki).
Izomerija organskih spojin
V anorganskih spojinah formula na splošno predstavlja eno samo spojino; tako obstaja samo ena snov s formulo H2SW4. Molekula žveplove kisline vsebuje dva atoma vodika, enega iz žvepla in štiri iz kisika, v posebni in edinstveni ureditvi. V organskih spojinah je redko, da se to zgodi. Tako na primer obstajata dve spojini, ki se odzivata na formulo C2H6Ali pa etilni alkohol ali etanol in dimetil eter.

Bolj ko je molekula zapletena, to je večje število atomov ogljika, večje je število možnih izomerov.
Analiza organskih spojin
Analiza organske spojine vključuje kvalitativna analiza, kvantitativna analiza in Funkcionalna analiza. Če domnevamo, da je spojina v nečistem stanju, jo predhodno očistimo z Kristalizacija, Destilacija, Sublimacija, Pridobivanjeitd. Kriterij čistosti lahko presodimo na podlagi njegovih fizičnih konstant, kot so tališče, vrelišče, gostota, topnost, kristalna oblika, lomni količnik itd.
The kvalitativna analiza Preveri se z raziskovanjem prisotnosti elementov, ki tvorijo spojino, zlasti ogljika, vodika in dušika ter včasih halogenov, žvepla in fosforja.
The kvantitativna analiza Izvaja se na osnovi metod, ki se uporabljajo za kvalitativno analizo. Izhodišče je določena količina snovi, ki zgoreva, ogljikov dioksid pa se zbira in stehta. ogljik in vodna para, tvorjena za izračun odstotka ogljika in vodika v spojina. Rezultati kvantitativne analize olajšajo izračun empirična formula, čeprav je molekulsko formulo mogoče najti šele po določitvi molekulske mase snovi. Toda problem še ni rešen, ker enaka molekulska formula lahko ustreza različnim izomerom.
Klasifikacija organskih spojin
Po svoji strukturi organske spojine delimo na spojine alifatski, aromatičen Y. heterocikličen. Alifatske spojine so povezane z metanom CH4, so odprte verige, razen cikloparafinov, in svoje ime dolgujejo dejstvu, da v to skupino spadajo živalske in rastlinske maščobe.
The aromatske spojine, zaprta veriga, tesno povezana z benzenom, C6H6in svoje ime dolgujejo dejstvu, da imajo mnogi dišeče, prijetne vonjave.
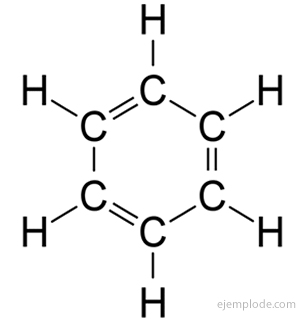
Benzenov obroč
The heterociklične spojine So zaprte verižne spojine, v katerih v obroču ni element, ki ni ogljik.
Po svoji ustavi so:
Ogljikovodiki, ki pa je zaradi vrste povezav uvrščena med Alkani, Alkeni Y. Alkini. Poleg tega so v to kategorijo cikloalkani, benzen in njihovi derivati, sestavljeni samo iz ogljika in vodika.
Heterociklične spojine
Halogenirani derivati:R-X
Nitro spojine:R-NE2
Sulfonske kisline:R-SO3H
Nitrili (ALI alkil cianidi) in izonitrili:R-CN in R-NC. Razlikujejo se po tem, kako je atom dušika vezan v molekuli.
Alkoholi:R-OH
Fenoli: Spojine na osnovi hrbtenice, sestavljene iz benzenskega obroča z dodano hidroksilno skupino.

Eteri:R-O-R
Merkaptani: R-SH
Tioetri:R-S-R
Tiokisline:R-COSH
Aldehidi:R-CHO
Ketoni:R-CO-R
Karboksilne kisline:R-COOH
Greš ven:R-COOM (M za kovino)
Estri: R-COO-R
Anhidridi: R-CO-O-OC-R
Amini:R-NH2, R-NH-R, 2R-N-R
Ogljikovi hidrati tipa Aldosa:-CHOH-CHOH-CHO
Ketozni ogljikovi hidrati:-CHOH-CO-CH2Oh
Organokovinske spojine:R-M-R
Metal-alkil halogenidi:R-MX (znan tudi pod imenom Grignard Reagenti)