20 Примери киселинских соли
Мисцелланеа / / July 04, 2021
У неорганска хемија соли се називају једињења која се добијају када а киселина његови атоми водоника замењују се металним катионима (мада понекад и неметалним катионима, на пример, амонијум-катионом, НХ4+). У конкретном случају киселе соли, водоници киселине су делимично супституисани, односно најмање један несупституисани водоник остаје као део соли. У томе што се разликују од неутралне соли, где су водоници киселине потпуно супституисани.
Тхе изађи обично настају реакцијом између а киселина и а хидроксид (база). У овим реакцијама база обично губи своје хидроксилне групе (-ОХ), а киселина их губи. атома водоник (Х), формирајући неутралну со; али ако киселина у питању сачува бар један од својих атома водоника, мењајући електрични набој реакције, добићемо киселу со или хидрогенирану со.
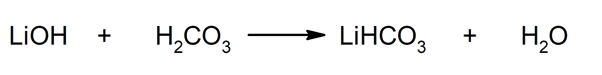
Тако се, на пример, литијум бикарбонат и вода добијају реакцијом између литијум хидроксида и угљене киселине:
Номенклатура киселих соли
Киселе соли могу се именовати према три врсте најчешћа номенклатура:
Примери киселинских соли
- Натријум бикарбоната (НаХЦО3). Такође се назива натријум хидроген карбонат (ИВ), то је бела кристална чврста супстанца, растворљива у води, која се у природи може наћи у држави минерална или се може произвести у лабораторији. Једна је од најпознатијих киселих соли и широко се користи у кондиторима, фармакологији или јогурту.
- Литијум бикарбонат (ЛиХЦО3). Ова кисела сол је коришћена као средство за хватање ЦО2 у ситуацијама када је такав гас непожељан, као у северноамеричким свемирским мисијама „Аполло“.
- Калијум дихидроген фосфат (КХ2ПО4). То је кристална чврста супстанца, без мириса, растворљива у води, широко коришћена у разним индустријама попут квасца храна, хелатно средство, хранљиво средство и помоћник у процесима ферментације.
- Натријум бисулфат (НаХСО4). То је кисела со која настаје неутрализацијом сумпорне киселине. Широко се користи у рафинацији метала и производима за чишћење. Иако је врло токсичан за неке иглокожце, користи се као адитив у храни за кућне љубимце и у производњи накита.
- Натријум хидроген сулфид (НаХС). Са њим је опасно једињење, јер је врло корозивно и отровно. Може да изазове озбиљне опекотине коже и оштећења очију, јер је такође запаљив.
- Калцијум хидроген фосфат (ЦаХПО4). Користи се као додатак исхрани у житарице за стоку. То је чврста супстанца нерастворљива у води, али кад кисели када је хидрира, троши две молекула воде.
- Амонијум хидроген карбонат ([НХ4] ХЦО3). Такође познат као „амонијум бикарбонат“, користи се у прехрамбеној индустрији као квасац хемијска, иако има недостатак што хвата амонијак и даје храни неукусан укус ако се користи вишак. Такође се користи у апаратима за гашење пожара, за производњу пигмената и за ширење гуме.
- Бари бикарбонатили (Ба [ХЦО3]2). То је кисела со која када се загреје може да преокрене своју производну реакцију и изузетно је нестабилна, осим у раствору. Широко се користи у керамичкој индустрији.
- Натријум бисулфит (НаХСО3). Ова сол је изузетно нестабилна и у присуству кисеоника добија се у натријум сулфат (На2СВ4), због чега се користи у прехрамбеној индустрији као конзерванс и средство за сушење. Екстремно је редукционо средство и често га користи човек, користи се и за фиксирање боја.
- Калцијум цитрат (АЦ3[Ц.6Х.5ИЛИ7]2). Обично позната као горка со, користи се као конзерванс за храну и као додатак исхрани када је повезана са аминокиселином лизином. То је бели кристални прах без мириса.
- Монокалцијум фосфат (Ца [Х2ПО4]2). То је безбојна чврста супстанца која се добија реакцијом калцијум-хидроксида и фосфорне киселине, која се широко користи као средство за квашење или као ђубриво у пољопривредним радовима.
- Дикалцијум фосфат (ЦаХПО4). Такође познат као калцијум монохидроген фосфат, има три различита кристална облика који се користе као додатак храни и присутан је у зубним пастама. Поред тога, природно се формира у бубрежним каменцима и у такозваном „бубрежном камену“.
- Мономагнезијум фосфат (МгХ4П.2ИЛИ8). То је бела, кристална сол без мириса, делимично растворљива у води. Користи се за очување хране, као средство за закисељавање, као коректор киселости или средство у лечењу брашна.
- Натријум диацетат (НаХ [Ц2Х.3ИЛИ2]2). Ова сол се користи као арома и конзерванс у оброцима, што спречава или одлаже појаву печурке и микобактерије, како у вакуумски упакованим производима као што су месни производи, тако и у индустрији брашна.
- Калцијум бикарбонат (Ца [ХЦО3]2). То је хидрогенизована со која потиче од калцијум-карбоната, присутна у минералима попут кречњака, мермера и других. Ова реакција укључује присуство воде и ЦО2, па се може спонтано јавити у пећинама и пећинама богатим калцијумом.
- Флуорид рубидијумске киселине (РбХФ). Ова сол се добија реакцијом флуороводоничне киселине (водоник и флуор) и рубидијума, алкалног метала. Резултат је токсично и нагризајуће једињење са којим се мора поступати опрезно.
- Моноамонијум фосфат ([НХ4] Х.2ПО4). То је сол растворљива у води која настаје реакцијом амонијака и фосфорне киселине. Обично се користи као ђубриво, јер земљишту даје хранљиве материје азота и фосфора неопходних за раст биљака. Такође је део АБЦ праха у апаратима за гашење пожара.
- Цинк водоник ортоборат (Зн [ХБО3]). То је сол која се користи као антисептик и као адитив у производњи керамике.
- Мононатријум фосфат (НаХ2ПО4). Користи се углавном у лабораторијама, као „пуфер“ или пуферски раствор, који спречава нагле промене пХ раствора.
- Калијум хидроген фталат (КХП). Називан и „фталат калијумове киселине“, чврста је и стабилна со у обичном ваздуху, због чега се често користи као примарни стандард у мерењу пХ. Такође је користан као пуферско средство у хемијске реакције.
Пратите са:
