Пример хемијских основа
Хемија / / November 13, 2021
У општој хемији, Базе су категорија хемикалија који испуњавају неколико функција:
-Реагујте са киселинама у неутрализацији, производећи сол и воду.
-Регулишите потенцијал водоника, пХ, подижући његову вредност ако се сипају у средину где се нађе реакција.
-Трчати као Хемијски реагенси за велики број реакција.
Базе могу бити различите врсте, обе Неорганска хемија као на Органска хемија, Као Хидроксиди, Амини и Алкохоли, на пример.
Да би се дефинисало понашање база, користе се три главне теорије киселинско-базних киселина: Аррхениусова, Бронстед-Ловријева и Левисова.
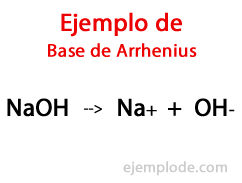
Основе према Аррениусу
Према шведском хемичару Сванте Аррхениус, Базе су оне хемијске супстанце које обезбеђују хидроксилне јоне (ОХ-) у реакциони медијум, посебно ако је водени раствор. Тако ће са расположивим хидроксил-јонима постојати а Алкални пХ, односно са вредношћу већом од 7, па све до 14 у зависности од тога колико је база присутна у тренутку мерења.
Ово је једна од најједноставнијих и најпрактичнијих теорија за примену, јер нема компликација за разликовање супстанци које учествују у реакцији. Добро је познато која је киселина, а која база.
У оквиру ове теорије постоје неспорно неоргански хидроксиди, као што су натријум хидроксид (НаОХ) и калијум хидроксид (КОХ).
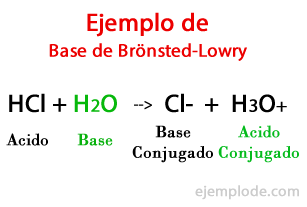
Базе према Бронстед-Ловри-у
Према теорији коју су формулисали Дански Јоханнес Бронстед и британски Тхомас Мартин Ловри, База је хемијска врста способан да прими протоне које ће дати друга, киселина током хемијске реакције. Протон је генерално повезан са позитивним наелектрисањем које га карактерише, па га можемо поново повезати са водоник-јонима (Х +).
Када дође до размене у хемијској реакцији, производи се зову: „Коњугована базна киселина“ и „Коњугована базна киселина“, на основу реактаната који су их формирали.
За ову теорију, Амонијак (НХ3) је најрепрезентативнији случај. За Бронстеда и Ловрија супстанце које су способне да задрже водоникове јоне (Х +) су базе. У овом случају, амонијак ће се, понашајући се као база, стећи водоник у својој структури, учвршћујући се као амонијум-јон (НХ4+), са вишком позитивног наелектрисања водоника. Амонијум је коњугована киселина амонијака.
Амини, органска једињења добијена из амонијака (НХ3), као што је метил амин (ЦХ3НХ2), када се у решењу понашају као базе и способни су да примају позитивне наелектрисања у својој структури, било од водоника или карбокације.
Карбокација је органски јон настао као ланац угљоводоника, који у одсуству негативног јона, који То може бити хидроксил (ОХ-) или халоген (Цл-, Бр-), тежи да се веже за локацију која га може примити, што ће бити База.
Основе према Луису
Амерички научник Гилберт Левис истакао је у својој теорији киселина-база да су базе су оне супстанце које су способне да допринесу својим паровима слободних електрона да би други довршио свој октет.
Ова киселинско-базна теорија је додатак да се поново потврди валидност њеног правила октета, у којем се описује како атоми стичу стабилност постизањем броја осам електрона у њиховој последњој љусци, користећи Везу Ковалентни
Хидроксилни јон је добар пример Луисове базе. Има пар слободних електрона на које може доћи водоник-јон који нема електроне. Настаће молекул Воде. Тако ће се створити октет за кисеоник молекула, а водоники, који су мањи атоми, имаће свој пар електрона који ће их учинити стабилним.

Употреба важних основа
Тхе Натријум хидроксид НаОХ Обично се користи у воденом раствору за чишћење очврснуле масти у домаћим и индустријским пећима, ефикасно је растварајући. Такође се користи у концентрованом раствору када се појаве непредвиђена изливања киселе супстанце за њено неутралисање.
Тхе Магнезијум хидроксид Мг (ОХ)2 Користи се у раствору названом "Магнезијево млеко", за решавање жгаравице, неутралишући је. Продаје се у апотекама.
Тхе Калијум хидроксид КОХ Користи се као реагенс за процесе сапонификације, претварајући масти у сапун.
Тхе Амонијак НХ3 У свом гасовитом облику користи се као индустријско расхладно средство, посебно у уређајима за производњу леда. Веома је опасно за употребу, јер удисање концентрације од 5 милиграма по литру у ваздуху може бити кобно.
Примери хемијских основа
Вода Х.2ИЛИ
Амонијак НХ3
Натријум хидроксид НаОХ
Калијум хидроксид КОХ
Магнезијум хидроксид Мг (ОХ)2
Калцијум хидроксид Ца (ОХ)2
Алуминијум-хидроксид Ал (ОХ)3
Амонијум хидроксид НХ4Ох
Фе-хидроксид Фе (ОХ)2
Фе-хидроксид Фе (ОХ)3
Хидроксил-јон (ОХ-)
Хлоридни јон (Цл-)
Бромид-јон (Бр-)

