Врсте хемијских веза
Хемија / / July 04, 2021
Када два или више атома формирају молекул, они се спајају помоћу а спој између електрона његових последњих слојева, најповршнији. Ова унија се зове Хемијска веза. Да би се створила хемијска веза, атоми морају да имају своје непотпуни октет, односно мање од осам електрона у њиховој последњој љусци, што је број који ће им дати хемијску стабилност.
Постоје три врсте хемијских веза:
- Јонске везе
- Ковалентне везе
- Металне везе
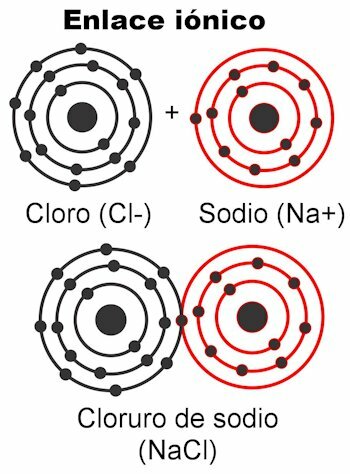
Јонске везе
Јонске везе су оне у којима су валентни електрони привлаче их електростатичке силе. Атоми (атоми) који имају 1 до 4 валентна електрона могу их испоручити да би створили везу; То му даје позитиван набој, јер би се ослободило негативног набоја. С друге стране, атом (и) који имају 5 до 7 валентних електрона моћи ће да приме неопходне да би достигли 8.
То им даје негативан набој, јер они узимају електроне, који су негативни. Чињеница да се електрони могу ухватити или испоручити даје атомима електрични набој. Према Куломбовом закону, наелектрисања су настала на оба атома
они ће силом привући једни друге, што је горе поменута електростатика. Негативни терети привлаче позитивне оптужбе и обрнуто. Привлаче се супротни набоји. Једном када их ова сила веже, молекул се формира.Јонске везе се углавном јављају између атома метала и неметала. Метали се одричу својих електрона и увек носе позитиван набој, учествујући као катион (+). Неметали су електронски рецептори и углавном носе негативан набој, учествују као ањони (-), али такође се дешава да носе позитиван набој, и то када чине групе наелектрисаних атома позвао радикали, као амонијум НХ4+, карбонат ЦО3-2, фосфат ПО4-3.
Међу хемијским једињењима која настају јонским везама су:
- Бинарне соли
- Окисалес
Када се ове супстанце растворе у води раздвајају се, Наиме, одвојени у њихове електричне набоје и они се распршују у води заједно са јоновима водоника Х.+ и хидроксил (ОХ-) који формирају воду. Смеша која настаје је раствор тзв електролит.
- Наставите са читањем: Јонска веза
Ковалентне везе
Ковалентне везе су оне у којима се деле електрони не одвајајући их од атома, односно без стварања електричних наелектрисања. Атоми се блиско држе заједно и користе силу којом језгро привлачи електроне. Једном када се веза формира, два или више језгара атома на крају привлаче заједничке електроне, испуњавајући на тај начин правило октета и чинећи молекул стабилним.
Постоји неколико облика ковалентне везе, а то су:
- Ковалентна веза
- Координатна ковалентна веза
- Поларна ковалентна веза
- Неполарна ковалентна веза
Тхе ковалентна веза Управо је попут оне која је описана на почетку. Атоми који учествују деле електроне тако да сви имају свој комплетни октет. Овде нема електричних наелектрисања, јер се никакви електрони не одбацују, већ се само деле.
У координатна ковалентна веза само један атом доприноси свим електронима неопходним за везу. Други атом се једноставно веже и узима те електроне као своје. Молекул се формира овако. То је случај, на пример, са сумпорном киселином Х.2СВ4 у којој сумпор дели два пара електрона са атомима кисеоника.
У поларна ковалентна веза, силе између атома су нагнуте на једну страну молекула. Ово када постоје различите врсте атома у молекулу. Ова сила се мери у дебие јединицама и што је већа њена вредност на једној страни молекула, то ће бити поларнија. То значи да се у структури формирају полови и зато им је дато ово име. Његове силе су асиметричне.
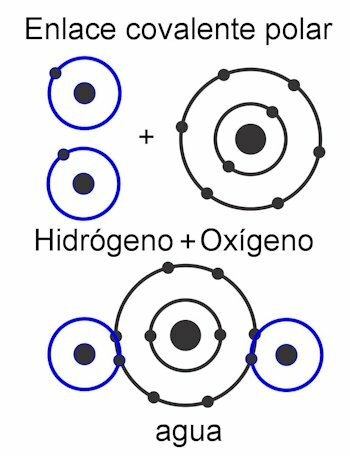
У неполарна ковалентна веза, силе између атома су уједначене у читавом молекулу, па се стога у његовој структури не формирају полови. Ради као једна целина и зато је врло тешко, готово немогуће, поделити његова оптерећења. Због тога је нерастворљив у води. Ово је случај са једињењима као што су алкани, који имају једнаке силе у целом молекулу. Његове силе су симетричне.

- Наставите са читањем: Ковалентна веза
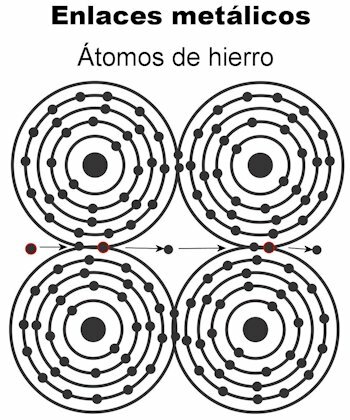
Метална веза
Атоми метала држе се заједно помоћу металних веза. У овој врсти везе, електрони свих атома се привлаче да би формирали кристалну решетку која остаје чврста. Везе кристалне решетке имају све електроне прошаране и уређена за пренос електричне струје и топлоте када им се преноси. У прелазним металима ова структура металних веза је изванреднија, јер су њихови атоми већи.
Примери јонског везивања
Неке супстанце које имају јонске везе су:
- НаЦл натријум хлорид. Његови јони су На+ и Цл-.
- Калијум хлорид КЦл. Његови јони су К.+ и Цл-.
- Калцијум хлорид ЦаЦл2. Његови јони су Ца+2 и Цл-.
- Магнезијум хлорид МгЦл2. Његови јони су Мг+2 и Цл-.
- Стронцијум хлорид СрЦл2. Његови јони су Ср+2 и Цл-.
- Баријум хлорид БаЦл2. Његови јони су Ба+2 и Цл-.
- Алуминијум хлорид АлЦл3. Његови јони су Ал+3 и Цл-.
- На натријум сулфат2СВ4. Његови јони су На+ И тако4-2.
- Калијум К сулфат2СВ4. Његови јони су К.+ И тако4-2.
- Калцијум сулфат ЦаСО4. Његови јони су Ца+2 И тако4-2.
- Калцијум сулфат МгСО4. Његови јони су Мг+2 И тако4-2.
- Стронцијум сулфат СрСО4. Његови јони су Ср+2 И тако4-2.
- Баријум-сулфат БаСО4. Његови јони су Ба+2 И тако4-2.
- На натријум фосфат3ПО4. Његови јони су На+ и ПО4-3.
- Калијум К фосфат3ПО4. Његови јони су К.+ и ПО4-3.
- Магнезијум фосфат Мг3(ПО4)2. Његови јони су Мг+2 и ПО4-3.
- Калцијум фосфат Ца3(ПО4)2. Његови јони су Ца+2 и ПО4-3.
- Алуминијум фосфат АлПО4. Његови јони су Ал+3 и ПО4-3.
- Ферофосфат Фе3(ПО4)2. Његови јони су Фе+2 и ПО4-3.
- Ферофосфат ФеПО4. Његови јони су Фе+3 и ПО4-3.
Примери ковалентне везе
Неке супстанце које представљају ковалентне везе су:
- Метан ЦХ4.
- Етан Ц.2Х.6.
- Пропан Ц.3Х.8.
- Бутан Ц.4Х.10.
- Пентане Ц.5Х.12.
- Хексан Ц.6Х.14.
- Хептан Ц.7Х.16.
- Октан Ц.8Х.18.
- Пропилен ЦХ2= ЦХ2–ЦХ3.
- Ацетилен Ц.2Х.2.
- Метил алкохол ЦХ3
- Етил алкохол Ц.2Х.5
- Пропил алкохол Ц.3Х.7
- Изопропил алкохол ЦХ3ЦХ (ОХ) ЦХ3.
- 2-пропанон или ацетон ЦХ3Цар3.
- Формалдехид ХЦХО.
- Ацеталдехид ЦХ3
- Пропионалдехид ЦХ3ЦХ2
- Бутиралдехид ЦХ3ЦХ2ЦХ2
- Мравља киселина ХЦООХ.
Примери металне везе
Неке супстанце које представљају металну везу су:
- Цинк Зн
- Цадмиум Цд
- Бакар Цу
- Силвер Аг
- Голд Ау
- Никал Ни
- Палладиум Пд
- Платинум Пт
- Цобалт Цо
- Рходиум Рх
- Иридиум Го
- Фе Фе
- Рутениум Ру
- Осмиум Ос
- Манган Мн
- Хром Цр
- Молибден Мо
- Волфрам В.
- Ванадијум В.
- Зрцониум Зр
Пратите са:
- Атоми
- Ион
- Метали
- Без метала
- Алкани
- Решења



