Exempel på kemiska element
Kemi / / July 04, 2021
Ett kemiskt grundämne det är en ren substans som består av atomer av samma typbildades i sin tur av ett antal protoner och neutroner i kärnanoch en mängd elektroner i sina orbitaler. Vissa finns naturligt, andra genom att bilda molekylerna i en förening, och andra har skapats genom genomförande av laboratorieprocedurer. Alla kemiska element utgör hela universums materia och upprätthåller människokroppens existens och funktion.
Varje element har egenskaper och beteenden som skiljer det och gör det unikt, men samtidigt presenterar den likheter med en grupp element i den manifestation som de har i universum. Av denna anledning finns det det periodiska systemet för kemiska element, som behandlar dessa likheter för att gruppera elementen på ett enhetligt sätt och göra det lättare att studera deras egenskaper.
Atomnummer för ett element
Atomen bär i kärnan ett antal protoner, åtföljt av samma antal neutroner. Till detta nummer det kallas atomnummer, representerad som Z för akademiska ändamål och i litteratur. För varje element kommer detta nummer att vara unikt. Det finns inga två element med samma atomnummer. Periodiska systemet fokuserar också på detta kriterium för att beställa dem.
Symbol för ett element
I tiderna med alkemi, som sträcker sig ungefär år 400 till 1000 e.Kr. C. registrerade alkemisterna sina experiment med tilldelning av symboler till elementen. De var enkla symboler, gjorda med geometriska figurer, för att representera det enskilda elementet och de studerade transformationerna.
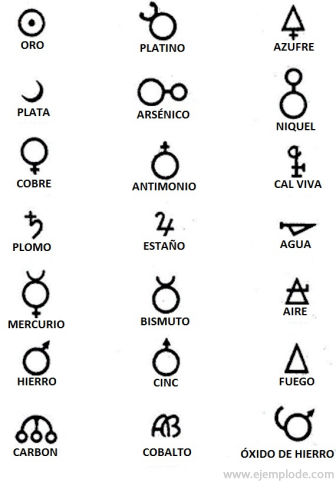
Några exempel på alkemiska symboler med namnet på elementet eller föreningen de representerade.
I eran för modern kemi representeras elementen fortfarande med symboler, i detta fall bokstäver som hänvisar till deras namn på latin eller engelska.
Till exempel:
Symbolen för Sodium är Na, med sitt latinska namn Natrium
Symbolen för guld är Au, med sitt latinska namn Aurum
Symbolen för Silver är Ag, med sitt latinska namn Argentum
Symbolen för koppar är Cu, med sitt latinska namn Cuprum
Antimonets symbol är Sb, med sitt latinska namn Stibium
Symbolen för Iron är Tro, med sitt latinska namn Ferrum
Merkurius symbol är Hg, med sitt latinska namn Hydrargyrum, vilket betyder "flytande silver"
Symbolen för kalium är K, med sitt latinska namn Kalium
Kemiska elementgrupper:
Periodiska systemet för kemiska element klassificerar dessa efter grupper: grupp A och grupp B. Grupp A är åtta, som innehåller elementen Alkalisk, den Alkaliskt jordnära, den Terreos, tre familjer av element, vars huvud definierar familjens namn: Kolfamilj, Kvävefamiljen, Svavelfamilj, den Halogener och den ädelgaser. Grupp B består av alla Övergångsmetaller och de sällsynta jordarterna, som också är två stora familjer: Lanthanides Y Actinides.
Grupp IA: Alkaliska element:
Serien av alkaliska element består av väte (H), litium (Li), natrium (Na), kalium (K), rubidium (Rb), cesium (Cs) och Francium (Fr). De har alla en elektronisk konfiguration så att de i det sista skalet har en elektron. Deras namn beror på att de reagerar och bildar alkalier eller hydroxider när de kommer i kontakt med vatten. Det är ett allmänt beteende mellan dessa element. Ju större elementets atom är, desto mer reaktiv är den, eftersom den kraft med vilken kärnan håller elektronen från det sista skalet har mindre och mindre räckvidd. De kan bilda jonbindningar med halogener. Till exempel: Den jonbindning som har en riklig närvaro är den av natrium-klor och bildar natriumklorid NaCl.
Grupp IIA: Alkaliska jordelement:
Dessa element är: Beryllium (Be), Magnesium (Mg), Kalcium (Ca), Strontium (Sr), Barium (Ba) och Radium (Ra). De är inte fria i naturen; å andra sidan finns dess karbonater och silikater i relativt stort överflöd. De är argentinska vita och kristallina. De kombineras enkelt med syre om de utsätts för luft. Detta beror delvis på det faktum att de har två elektroner i sitt sista skal, i överensstämmelse med syremottagande kapacitet. Barium är gruppens mest aktiva element, och tillsammans med kalcium är de de med de mest industriella applikationerna i gruppen.
Grupp IIIA: Jordelement:
Grupp IIIA består av elementen Bor (B), Aluminium (Al), Gallium (Ga), Indium (In) och Thallium (Tl). Bor är ett icke-metalliskt element, aluminium är amfotert (amfiprotiskt), det vill säga det kan fungera som en syra och som en bas; och de andra tre är metalliska element. De har tre elektroner i sitt sista skal och genererar en valens på +3, även om Gallium ibland verkar med en +1 och +2 valens i några av dess föreningar. Bor är det enda elementet i denna serie som bildar hydrider. Bor och aluminium bildar karbider.
Grupp IVA: Kolfamiljen:
De representativa elementen i grupp IVA är kol (C), kisel (Si), Germanium (Ge), tenn (Sn) och bly (Pb). De två första är i grunden icke-metalliska i sina egenskaper, men Germanium, Tenn och Bly är metalliska, och ju mer desto högre är deras atomnummer. Med undantag av kisel har varje element valenser +4 och +2.
Kol och kisel bildar föreningar där elementets atomer är förenade av par av delade elektroner. Kol är kärnan i organiska föreningar genom att associeras med atomer av väte, syre, kväve, svavel och ibland kisel.
Kisel och Germanium används för tillverkning av elektroniska komponenter, eftersom de har egenskapen att bete sig som halvledare.
Grupp VA: Kvävefamilj:
Grupp VA består av elementen Kväve (N), fosfor (P), arsenik (As), antimon (Sb) och vismut (Bi). Kväve och fosfor är icke-metalliska, arsenik och antimon är metalloider och vismut är en metall. Dessa element kännetecknas av att man bildar hydrider, av vilka minst giftiga är ammoniak NH3. Kväve bildar salpetersyra HNO3, involverad tillsammans med saltsyra i Agua Regia, en blandning som kan lösa ädla metaller som guld och silver.
Kväve är också involverat i två stora grupper av organiska föreningar som kallas aminer och amider, som kan betraktas som derivat av ammoniak NH3genom substitution av ett väte med en kolvätekedja.
Grupp VIA: Oxygen Family:
Består av elementen Oxygen (O), Sulphur (S), Selen (Se), Tellurium (Te) och Polonium (Po). Syre är den mest aktiva och har förmågan att enkelt bilda kovalenta bindningar. I kontakt med metaller i miljöer med hög luftfuktighet bildar det oxider. Det bildar en resonansmolekyl som heter Ozon, som skyddar planeten från UV-strålning.
Grupp VIIA: Halogener:
Dess namn betyder "Försäljningsformer". Gruppen består av elementen Fluor (F), Klor (Cl), Brom (Br), Jod (I) och Astate (At). De har sju elektroner i det sista skalet, vilket gör att de kan vara receptorer för en elektron. Denna kvalitet gör att de kopplas till elementen i grupp IA och bildar binära salter. Fluor kännetecknas av att den har den största elektronegativiteten i hela det periodiska systemet, med ett värde på 4,0, vars motsvarighet är Cesium, med elektronegativitet 0,7. Denna egenskap gör det möjligt för den att ha styrkan att locka andra atomer och prioritera att bilda ett band med de.
Grupp VIIIA: Ädla gaser:
Även kallad Inert Gas Group, består den av elementen Helium (He), Neon (Ne), Argon (Ar), Krypton (Kr), Xenon (Xe) och Radon (Ra). De är elementen som har all sin fullständiga elektroniska konfiguration, så de kan inte reagera under vanliga förhållanden. De används främst för lysande kommersiella skyltar och avger synligt ljus när en elektrisk ström inträffar på dem.
Grupp B: Övergångsmetaller:
I tio grupper om vardera tre element grupperas övergångsmetallerna. Dessa inkluderar de bästa elektriska ledarna: Silver (Ag), Koppar (Cu), Guld (Au); de bästa strukturella komponenterna för stadsbyggande och teknik; Järn (Fe), Titan (Ti), Aluminium (Al), Zirkonium (Zr), Volfram (W); de bästa katalysatorkomponenterna: Nickel (Ni), Vanadium (V), Platina (Pt); och huvudbeläggningsingredienserna: Kadmium (Cd), Krom (Cr), Zink (Zn). De hanterar vanligtvis valenser mellan +1 och +3, men element som krom hanterar valenser +2, +3, +6.
Sällsynta jordarter: Lanthanides och Actinides:
De kallas sällsynta jordarter på grund av sin brist på planeten. De består av två grupper: Lanthanides och Actinides. De finns på de två separata raderna i det periodiska systemet. De arbetar med en valens på +3 i allmänhet och tenderar att bilda hydroxider. Det viktigaste elementet bland dem är Cerium, som används vid framställning av pyroforiska legeringar (Alloy Mischmetal, för stenar för tändare), i gasslangar för belysning och vid tillverkning av specialglas som absorberar ultravioletta strålar och värmestrålning.
De mest kraftfulla radioaktiva elementen, såsom uran (U) och plutonium (Pu), ingår i dessa grupper. som med tanke på deras instabilitet, släpper energi och går sönder, förlorar alfapartiklar (kärnor av Helium). Senare blir de mindre instabila element, enligt den radioaktiva serien.
