Oorganisk föreningens nomenklaturexempel
Kemi / / July 04, 2021
De nomenklatur för oorganiska föreningar: Oorganiska föreningar är kombinationer av kemiska element som har som produktmolekyler i vilka de är De kombinerar de flesta av de kemiska grundämnena, men de har inte baserna för sin huvudstruktur kol. Detta betyder inte att det inte finns några oorganiska molekyler med kol, utan att dessa inte har egenskaperna hos organiska molekyler.
Genom historien har många ämnen fått olika namn, av vilka några har hållit till denna dag. Detta är till exempel fallet med det ämne som kallas salfumán, saltsprit, havssyra eller mursyra. Ämnen som har varit kända sedan antiken har haft olika användningsområden och olika namn.
Inför denna mångfald av namnen på kemiska föreningar och molekyler, och behovet av att ha enhetliga regler som var användbara för alla forskare, akademiker, studenter och industrimän, 1919 IUPAC (International Union of Pure and Applied Chemistry: International Union of Pure and Applied Chemistry), som är den organ som ansvarar för att fastställa namnen och symboler för kemiska element, samt att standardisera namnen på molekyler och föreningar kemikalier.
IUPAC har godkänt två system för namngivning av oorganiska kemiska föreningar, som tillsammans med det traditionella systemet används idag.
Traditionell nomenklatur:
Det är det äldsta systemet, för närvarande används det främst inom handel och vissa traditionella industrier. Använd några suffix för att ange skillnaden mellan ämnen som består av samma element i olika kombinationer, med hjälp av suffixet –oso för de nedre valenserna, och –ico för de mer hög.
- Exempel: FeO: Järnoxid; Tro2ELLER3: Järnoxid; Tro3ELLER4: Järn-järnoxid.
Lagernomenklatur:
Det används ofta under större delen av 1900-talet och använder romerska siffror för att identifiera föreningar med liknande strukturer där vissa av elementen reagerar med olika valenser.
- Exempel: FeO: Järn (II) oxid; Tro2ELLER3: Järn (III) oxid; Tro3ELLER4: Järnoxid (II, III).
Stökiometrisk nomenklatur:
Den stökiometriska nomenklaturen är den senaste och den som främst används bland forskare och akademiker sedan dess har en enklare struktur genom att använda numeriska prefix som anger antalet atomer eller joner för varje ämne i molekyl.
- Exempel: FeO: Järnoxid; Tro2ELLER3: di järntrioxid; Tro3ELLER4: Tri-järn tetraoxid
Skriva kemiska formler.
Som en del av nomenklaturen måste en kemisk formel för en förening skrivas enligt en viss ordningsföljd och dess avläsning följer också en regel.
De mest elektro-positiva elementen skrivs först och sist de element eller radikaler som verkar med elektronegativ valens.
Exempel: När det gäller väte, när det kombineras med en icke-metall för att bilda en syra, har den en positiv valens, medan den icke-metallen har en negativ valens. Så först kommer symbolen för väte att skrivas och sedan symbolen för klor: H+ + Cl– = HCl.
I fallet med en hydrid verkar väte med en negativ valens och metallen har en positiv valens, så metallelementet kommer att skrivas först och sedan väte: Na+ + H– = NaH
När det gäller en radikal, såsom oxhydridradikalen (–OH), verkar den alltid med negativ valens, så den kommer att skrivas i slutet av formeln: Na+ + OH– = NaOH
Läsningens sätt görs från höger till vänster, det vill säga elementet eller radikalt elektronegativ ger typen av förening i fråga och den positiva radikalen komponenten som påverkar. När det gäller syror ges namnet enligt dess struktur, så enligt denna regel är det uppkallat efter elementet negativ elektro eller syra, kommer att vara korrekta former, även om det är föredraget att namnge det som syra, med slutet –Hydric. I ovanstående exempel kommer föreningarna att ha följande namn:
HCl = Väteklorid och saltsyra (detta bör helst användas).
NaH = natriumhydrid.
NaOH = natriumhydroxid.
Vid salt.
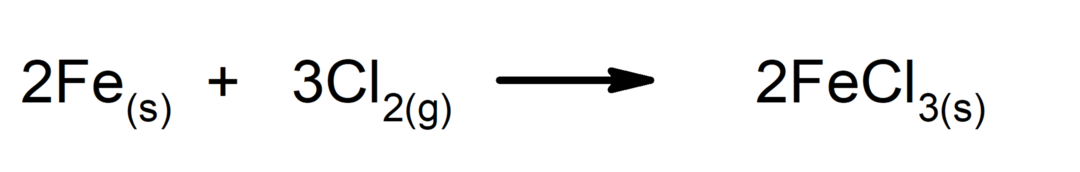
FeCl3 = Järnklorid (traditionell), järn II-klorid (lager), järntriklorid (stökiometrisk).
10 Exempel på nomenklaturer av oorganiska föreningar:
1. H2SW4 (2 väteatomer + sulfatjon [SO4])
Traditionell nomenklatur: Vitriololja, Vitriolalkohol, Svavelsyra.
Lagernomenklatur: Svavelsyra.
Stökiometrisk nomenklatur: Svavelsyra.
2. Cu2SW4. (2 kopparatomer + sulfatjon).
Traditionell nomenklatur: vitriol, kopparsulfat.
Lagernomenklatur: Kopparsulfat I.
Stichiometric Nomenclature: Dicobre sulfate.
3. Cu2SW4. (2 kopparatomer + sulfatjon).
Traditionell nomenklatur: vitriol, kopparsulfat.
Lagernomenklatur: Kopparsulfat I.
Stichiometric Nomenclature: Dicobre sulfate.
4. CS2. (kolatom + 2 svavelatomer).
Traditionell nomenklatur: kolsulfid.
Lagernomenklatur: kolsulfid.
Stökiometrisk nomenklatur: koldisulfid.
5. NaOH. (natriumatom + hydroxyljon).
Traditionell nomenklatur: kaustisk läsk, natriumhydroxid.
Lagernomenklatur: natriumhydroxid.
Stökiometrisk nomenklatur: natriumhydroxid.
6. Ba (OH)2. (bariumatom + 2 hydroxyljoner).
Traditionell nomenklatur: bariumhydroxid.
Lagernomenklatur: bariumhydroxid.
Stökiometrisk nomenklatur: bariumdihydroxid.
7. CuOH. (kopparatom + hydroxyljon).
Traditionell nomenklatur: kopparhydroxid.
Lagernomenklatur: kopparhydroxid I.
Stökiometrisk nomenklatur: kopparhydroxid.
8. Cu (OH)2. (kopparatom + 2 hydroxyljoner).
Traditionell nomenklatur: kopparhydroxid.
Lagernomenklatur: kopparhydroxid II.
Stökiometrisk nomenklatur: koppardihydroxid.
9. AuOH. (guldatom + hydroxyljon).
Traditionell nomenklatur: Aurous hydroxide.
Lagernomenklatur: guldhydroxid I.
Stökiometrisk nomenklatur: guldhydroxid.
10. Au (OH)3. (bariumatom + 3 hydroxyljoner).
Traditionell nomenklatur: auric hydroxide.
Lagernomenklatur: guldhydroxid III.
Stökiometrisk nomenklatur: bariumtrihydroxid.