คำจำกัดความของเรขาคณิตโมเลกุล
เบ็ดเตล็ด / / January 11, 2022
คำจำกัดความของแนวคิด
มันคือโครงสร้างของโมเลกุลที่กำหนดการจัดเรียงสามมิติของอะตอมที่ประกอบขึ้นในอวกาศ

วิศวกรเคมี
ปัจจุบันเรขาคณิตโมเลกุลถูกกำหนดตาม ทฤษฎี ของแรงผลักของคู่อิเล็กทรอนิกส์ของชั้นบาเลนเซีย (TRPECV) ทฤษฎีนี้ช่วยให้ทำนายพฤติกรรมได้ เคมี ของสาร (โดยเฉพาะโควาเลนต์) และช่วยให้เข้าใจ การกระจาย อิเล็กทรอนิกส์นำไปสู่ เรขาคณิต ของ โมเลกุล. ในทางกลับกัน ทำให้เราเข้าใจคุณสมบัติหลายอย่างที่สารได้มา
ทฤษฎีนี้มีพื้นฐานมาจากชุดของเสาหลักพื้นฐานที่เราจะทบทวนและพยายามทำความเข้าใจ แอปพลิเคชัน ฝึกฝน. ในตอนแรกอิเล็กตรอนที่ถูกผูกมัดและไม่ผูกมัด (วาเลนซ์) ถือเป็นทะเลของอิเล็กตรอนซึ่งโดย มีประจุชนิดเดียวกัน ผลักกัน จะอยู่ให้ไกลจากใจกลางอะตอมเสมอ โมเลกุล
ประการที่สอง "ทะเล" ของอิเล็กตรอนหรือ "เมฆอิเล็กทรอนิกส์" นี้ก่อให้เกิดพื้นที่ที่มีความหนาแน่นของอิเล็กตรอนสูง ที่ประกอบขึ้นเป็นพันธะ โดยที่อิเล็กตรอนจะถูกแบ่งหรือเป็นคู่ของอิเล็กตรอนที่ไม่แบ่งใช้ ในทางกลับกัน พันธะที่เกิดขึ้นสามารถเป็นแบบเดี่ยว สองเท่า หรือสามเท่าก็ได้
สุดท้ายสำหรับ ตัดสินใจ เรขาคณิตของโมเลกุล มีประโยชน์มากที่จะมีโครงสร้างลูอิส โดยจะนับจำนวนความหนาแน่นของอิเล็กตรอนรอบอะตอมกลางและจะให้
ข้อบ่งชี้ จากชื่อเรขาคณิตและรูปร่างที่โมเลกุลใช้สร้างสามมิติควรสังเกตว่าความหนาแน่นเหล่านี้จะอยู่ห่างกันมากที่สุด เพื่อที่จะนำโครงสร้างที่เสถียรที่สุดมาใช้และมีแรงผลักน้อยกว่า นี่คือวิธีการ ขั้นแรกให้ระบุเรขาคณิตอิเล็กทรอนิกส์ จากนั้นจึงระบุเรขาคณิตของโมเลกุล
ความหนาแน่นหกระดับ
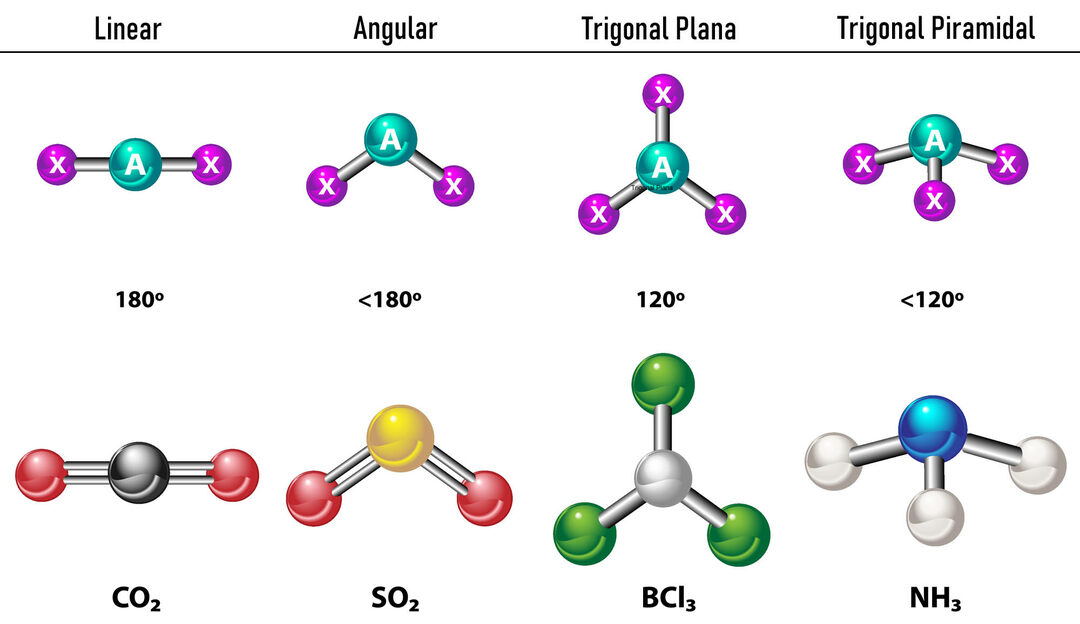
ในกรณีที่มีความหนาแน่นของอิเล็กตรอน 2 ตัวรอบอะตอมกลาง พันธะจะอยู่ห่างกันมากที่สุด ระหว่างพวกมัน กล่าวคือ 180º จากกันและกัน ดังนั้น เรขาคณิตอิเล็กทรอนิกส์ของพวกมันจึงเป็นเส้นตรงและในระดับโมเลกุล มันก็ยังเป็นเส้นตรงด้วย
ในกรณีที่มีความหนาแน่นของอิเล็กตรอนสามตัวรอบอะตอมกลาง มีสองทางเลือก: พันธะสามพันธะหรือพันธะสองพันธะและคู่ที่ไม่ผูกมัดหนึ่งคู่ หากมีสามพันธะ เรขาคณิตอิเล็กทรอนิกส์คือ แฟลตตรีโกณมิติโดยมีมุม 120º ระหว่างพันธะและเรขาคณิตโมเลกุลใช้ชื่อเดียวกัน ทีนี้ถ้ามีคู่ที่ไม่ผูกมัดก็ผลักไสกันมากขึ้น ความเข้ม ประจุที่ถูกผูกมัดจึงมีแนวโน้มที่จะบีบอัดมุมพันธะ มุมระหว่างคู่อิสระและพันธะแต่ละอันคือ 120º และเรขาคณิตอิเล็กทรอนิกส์คือระนาบตรีกอน ในขณะที่เรขาคณิตของโมเลกุลคือเชิงมุม
ในกรณีที่มีความหนาแน่นของอิเล็กตรอนสี่ตัวรอบอะตอมกลาง เรขาคณิตอิเล็กทรอนิกส์จะเป็นทรงสี่เหลี่ยมจตุรัส หากอิเล็กตรอนทั้งสี่คู่ถูกผูกมัด เรขาคณิตโมเลกุลของพวกมันจะตรงกับชื่อด้วยเรขาคณิตอิเล็กทรอนิกส์ของพวกมัน และมุมพันธะคือ109.5º ทีนี้ หากคู่ใดคู่หนึ่งว่าง มุมพันธะจะเล็กลง (107º) และเรขาคณิตของโมเลกุลจะเป็นประเภท พีระมิดตรีโกณมิติ. สุดท้าย ถ้าสองตัวเป็นคู่อิสระและอีกสองตัวถูกพันธะ มุมพันธะจะเท่ากับ 104.5º ในขณะที่เรียกว่าเรขาคณิตของโมเลกุล เชิงมุม.
เมื่อความหนาแน่นของอิเล็กตรอนรอบอะตอมตรงกลางเท่ากับ 5 จะเรียกว่า a Bipyramid ตรีโกณมิติ เรขาคณิตอิเล็กทรอนิกส์ของมัน หากโหลดทั้งหมดเชื่อมโยงกัน จะมีมุม 120ºC ระหว่างจุดเชื่อมที่ตั้งอยู่ในเส้นศูนย์สูตรและ 90º ระหว่างแนวแกนกับเส้นศูนย์สูตร ตอนนี้ เรขาคณิตของโมเลกุลเรียกอีกอย่างว่า Trigonal Bipyramid ในขณะที่มีคู่ที่เชื่อมโยงกันสี่คู่และคู่อิสระหนึ่งคู่ เรขาคณิตของโมเลกุลจะบิดเบี้ยวเป็นที่รู้จักกันดี "ร็อกเกอร์” มีชื่อที่ได้รับคือ จัตุรมุขบิดเบี้ยว. ในขณะที่ถ้าสองในห้าคู่ของอิเล็กตรอนว่างและสามตัวถูกผูกมัด ก็มีรูปทรงเรขาคณิต "T" และชื่อก็เป็นเพราะโครงสร้างของอิเลคตรอน สุดท้าย ถ้ามันกลับด้าน สามคู่อิสระและสองประจุที่ถูกผูกมัด เรขาคณิตของโมเลกุลจะเป็นเส้นตรง
ในที่สุด มีความหนาแน่นของอิเล็กตรอน 6 ตัวรอบ ๆ อะตอมกลางและรูปแปดด้านก่อตัวขึ้น จึงเป็นที่มาของชื่อในเรขาคณิตอิเล็กทรอนิกส์ ในทำนองเดียวกัน เรขาคณิตของโมเลกุลจะถูกตั้งชื่อหากคู่ทั้งหมดเชื่อมโยงกัน หากคุณมีคู่ที่เชื่อมโยงกันห้าคู่และคู่อิสระหนึ่งคู่ เรขาคณิตของโมเลกุลคือ Square Base Pyramid หากคุณมีคู่พันธะสี่คู่และคู่อิสระสองคู่ เรขาคณิตโมเลกุลคือ แฟลตสี่เหลี่ยม.
รูป: ธรรมชาติอันแสนหวาน
หัวข้อในเรขาคณิตโมเลกุล