ตัวอย่างของปฏิกิริยาดูดความร้อน
ตัวอย่าง / / November 09, 2023
ก ปฏิกิริยาดูดความร้อน เป็นปฏิกิริยาที่ดูดซับพลังงานจากตัวกลางในรูปของความร้อน ในปฏิกิริยาเหล่านี้ เพื่อให้สารตั้งต้นเปลี่ยนเป็นผลิตภัณฑ์ จำเป็นสำหรับสารเหล่านี้ในการดูดซับความร้อน ซึ่งทำให้ผลิตภัณฑ์มีพลังงานมากกว่าสารตั้งต้นที่ทำให้เกิดสารเหล่านี้ ตัวอย่างของปฏิกิริยาดูดความร้อน ได้แก่: การสังเคราะห์ด้วยแสงและอิเล็กโทรไลซิสของน้ำ
- ดูสิ่งนี้ด้วย: ปฏิกริยาเคมี
ตัวอย่างปฏิกิริยาดูดความร้อนในชีวิตประจำวัน
ปฏิกิริยาดูดความร้อนหลักบางประการได้แก่:
การผลิตโอโซนในบรรยากาศ. โอโซนถูกสร้างขึ้นในบรรยากาศเมื่อออกซิเจนโมเลกุล (O2) ดูดซับรังสีอัลตราไวโอเลตและสลายตัว จากนั้นอะตอมออกซิเจน (O) ก็สามารถโต้ตอบกับโมเลกุลออกซิเจนอื่นได้ (O2) และเกิดเป็นโอโซน (O3).

การแยกน้ำด้วยไฟฟ้า. เป็นกระบวนการที่นำไปใช้ พลังงานไฟฟ้า ลงไปในน้ำเพื่อแยกออกเป็นสององค์ประกอบ ได้แก่ ไฮโดรเจน (H) และออกซิเจน (O)
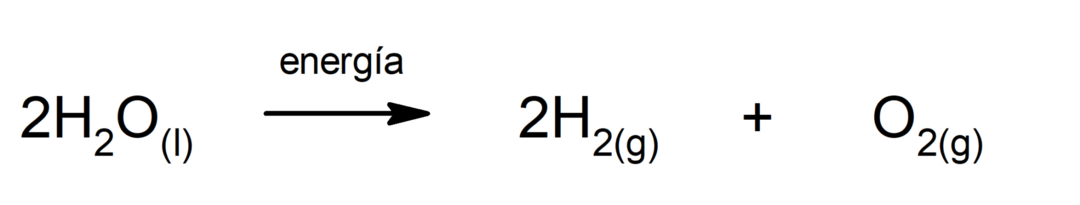
การสังเคราะห์ด้วยแสง. เป็นปฏิกิริยาเคมีที่ดูดซับ พลังงานแสงอาทิตย์, คาร์บอนไดออกไซด์ (CO2) จะถูกเปลี่ยนเป็นกลูโคส ปฏิกิริยานี้ถือเป็นเส้นทางหลักของสารอาหารสำหรับพืช
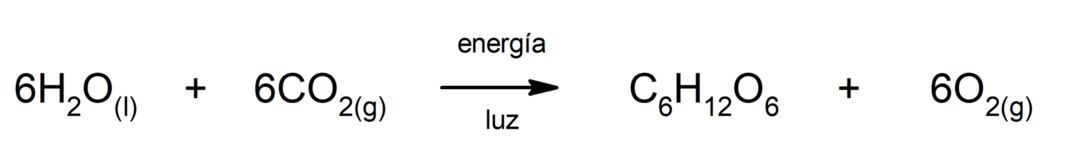
การผลิตเหล็ก (II) ซัลไฟด์. เพื่อให้ปฏิกิริยาระหว่างซัลเฟอร์กับเหล็กเกิดขึ้นจำเป็นต้องให้พลังงานในรูปของความร้อน
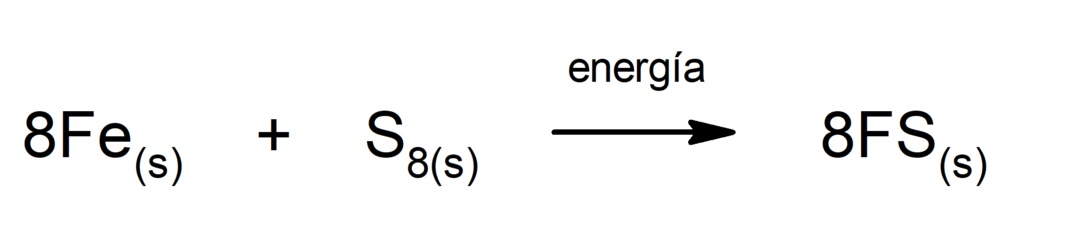
การสลายตัวของก๊าซคาร์บอนไดออกไซด์ (CO2). การสลายตัวของ CO2 ที่อุณหภูมิสูงจะผลิตก๊าซคาร์บอนมอนอกไซด์ (CO) และออกซิเจน (O2).
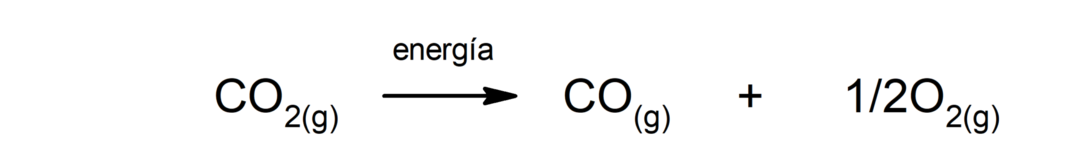
การสลายตัวของแคลเซียมคาร์บอเนต (CaCO3). แคลเซียมคาร์บอเนตสลายตัวด้วยการดูดซับความร้อนทำให้เกิดแคลเซียมออกไซด์ (CaO) และคาร์บอนไดออกไซด์ (CO2).
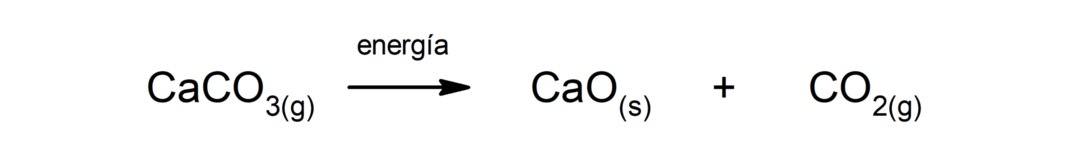
ความแตกต่างระหว่างปฏิกิริยาดูดความร้อนและปฏิกิริยาคายความร้อน
ความแตกต่างที่สำคัญระหว่างปฏิกิริยาดูดความร้อนและปฏิกิริยาคายความร้อนก็คือ ปฏิกิริยาดูดความร้อนจะดูดซับความร้อน ในขณะที่ปฏิกิริยาคายความร้อนจะปล่อยความร้อนออกมา
นอกจากนี้ ปฏิกิริยาดูดความร้อนยังมีลักษณะพิเศษคือเอนทาลปีเพิ่มขึ้น ในขณะที่ปฏิกิริยาคายความร้อนสัมพันธ์กับเอนทาลปีที่ลดลง
เอนทัลปีเป็นปริมาณทางอุณหพลศาสตร์ที่กำหนดการไหลของพลังงานความร้อนที่ความดันคงที่ระหว่างปฏิกิริยาเคมี มันถูกแทนด้วยตัวอักษร H และการแปรผันของมันคือหนึ่งในตัวบ่งชี้หลักในการพิจารณาว่าปฏิกิริยาเคมีเป็นแบบดูดความร้อนหรือคายความร้อน
- หากปฏิกิริยาเคมีมีการเปลี่ยนแปลงเอนทาลปีมากกว่าศูนย์ (∆H > 0) เป็นแบบดูดความร้อน
- หากปฏิกิริยาเคมีมีการเปลี่ยนแปลงเอนทาลปีน้อยกว่าศูนย์ (∆H < 0) เป็นแบบคายความร้อน
ติดตามด้วย:
- ปรากฏการณ์เคมีฟิสิกส์
- เคมีในชีวิตประจำวัน
- เคมีในชีวิตประจำวัน
- เคมีอินทรีย์และอนินทรีย์
อ้างอิง
- โซโต-กอร์โดบา, เอส. (2016). ปฏิกิริยาดูดความร้อน พื้นที่เก็บข้อมูลด้านเทคนิค สถาบันเทคโนโลยีแห่งคอสตาริกา
- โคโรมินาส, เจ. (2017). ปฏิกิริยาเคมีในชีวิตประจำวัน อเลมบิก (90) 8-26.
- ซานเชซ, เอ็ม. ต. ม., & ซานเชซ, ม. ม. (2002). การศึกษาทดลองปฏิกิริยาดูดความร้อนสำหรับนักเรียน ESO. พงศาวดารเคมีของ RSEQ, (4), 36-39.