ตัวอย่างองค์ประกอบทางเคมี
เคมี / / July 04, 2021
องค์ประกอบทางเคมี เป็นสารบริสุทธิ์ที่ประกอบด้วยอะตอมชนิดเดียวกันกลับก่อตัวขึ้น โดยโปรตอนและนิวตรอนจำนวนหนึ่งในนิวเคลียสและปริมาณของ อิเล็กตรอนในออร์บิทัล. บางชนิดพบได้ตามธรรมชาติ บางชนิดเกิดจากการสร้างโมเลกุลของสารประกอบ และบางชนิดก็ถูกสร้างขึ้นผ่านขั้นตอนของห้องปฏิบัติการ องค์ประกอบทางเคมีทั้งหมดประกอบขึ้นเป็นเรื่องราวของจักรวาลทั้งหมด และรักษาการดำรงอยู่และการทำงานของร่างกายมนุษย์
แต่ละองค์ประกอบมีลักษณะและพฤติกรรมที่ทำให้แตกต่างและทำให้เป็นเอกลักษณ์ แต่ในขณะเดียวกันก็แสดงความคล้ายคลึงกันกับกลุ่มขององค์ประกอบในการสำแดงที่พวกเขามีใน จักรวาล. ด้วยเหตุผลนี้ มีตารางธาตุขององค์ประกอบทางเคมี ซึ่งกล่าวถึงความคล้ายคลึงกันเหล่านี้เพื่อจัดกลุ่มองค์ประกอบที่สอดคล้องกัน และทำให้ศึกษาคุณสมบัติของธาตุได้ง่ายขึ้น
เลขอะตอมของธาตุ
อะตอม มีโปรตอนจำนวนหนึ่งอยู่ในนิวเคลียสพร้อมกับจำนวนนิวตรอนเท่ากัน. ถึงเบอร์นี้ เรียกว่าเลขอะตอม, แสดงเป็น Z เพื่อวัตถุประสงค์ทางวิชาการและในวรรณคดี สำหรับแต่ละองค์ประกอบ หมายเลขนี้จะไม่ซ้ำกัน ไม่มีธาตุสองธาตุที่มีเลขอะตอมเท่ากัน ตารางธาตุยังเน้นที่เกณฑ์นี้สำหรับการสั่งซื้อ
สัญลักษณ์ขององค์ประกอบ
ในสมัยของการเล่นแร่แปรธาตุซึ่งครอบคลุมประมาณปีพ. C. นักเล่นแร่แปรธาตุบันทึกการทดลองของพวกเขาโดยกำหนดสัญลักษณ์ให้กับองค์ประกอบ พวกมันเป็นสัญลักษณ์ธรรมดาๆ ที่สร้างด้วยรูปทรงเรขาคณิต เพื่อแสดงถึงองค์ประกอบแต่ละอย่างและการเปลี่ยนแปลงที่ศึกษา
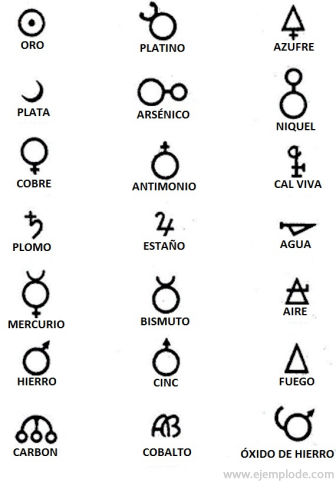
ตัวอย่างสัญลักษณ์การเล่นแร่แปรธาตุ โดยมีชื่อธาตุหรือสารประกอบที่แสดงอยู่
ในยุคของเคมีสมัยใหม่ องค์ประกอบยังคงแสดงด้วยสัญลักษณ์ ในกรณีนี้คือตัวอักษรที่อ้างถึงชื่อในภาษาละตินหรือภาษาอังกฤษ
ตัวอย่างเช่น:
สัญลักษณ์ของโซเดียมคือ นา, โดยใช้ชื่อภาษาละติน นาเทรียม
สัญลักษณ์ของทองคำคือ Au, โดยใช้ชื่อภาษาละติน ออรัม
สัญลักษณ์ของเงินคือ Ag, โดยใช้ชื่อภาษาละติน Argentum
สัญลักษณ์ของทองแดงคือ Cu, โดยใช้ชื่อภาษาละติน Cuprum
สัญลักษณ์ของพลวงคือ Sb, โดยใช้ชื่อภาษาละติน สติเบียม
สัญลักษณ์ของเหล็กคือ ศรัทธา, โดยใช้ชื่อภาษาละติน เฟอร์รัม
สัญลักษณ์ของดาวพุธคือ Hg, โดยใช้ชื่อภาษาละติน Hydrargyrumซึ่งหมายถึง "เงินเหลว"
สัญลักษณ์ของโพแทสเซียมคือ K, โดยใช้ชื่อภาษาละติน Kalium
กลุ่มองค์ประกอบทางเคมี:
ตารางธาตุขององค์ประกอบทางเคมีจำแนกตามกลุ่ม: กลุ่ม A และกลุ่ม B กลุ่ม A มีแปดซึ่งประกอบด้วยองค์ประกอบ อัลคาไลน์, ที่ อัลคาไลน์-Earthy, ที่ Terreos, สามตระกูลของ Elements ซึ่งหัวหน้ากำหนดชื่อของครอบครัว: ตระกูลคาร์บอน, ครอบครัวไนโตรเจน, ครอบครัวกำมะถัน, ที่ ฮาโลเจน และ ก๊าซมีตระกูล. กลุ่ม B ประกอบด้วย โลหะทรานซิชัน และ Rare Earths ซึ่งเป็นสองตระกูลที่ยิ่งใหญ่เช่นกัน: แลนทาไนด์ Y แอคติไนด์.
กลุ่ม IA: องค์ประกอบอัลคาไลน์:
ชุดขององค์ประกอบอัลคาไลน์ประกอบด้วยไฮโดรเจน (H), ลิเธียม (Li), โซเดียม (Na), โพแทสเซียม (K), รูบิเดียม (Rb), ซีเซียม (Cs) และแฟรนเซียม (Fr) พวกเขาทั้งหมดมีการกำหนดค่าทางอิเล็กทรอนิกส์เพื่อให้ในเปลือกสุดท้ายมีอิเล็กตรอน ชื่อของพวกมันเกิดจากการที่เมื่อสัมผัสกับน้ำ พวกมันจะทำปฏิกิริยาในรูปแบบอัลคาลิสหรือไฮดรอกไซด์ เป็นพฤติกรรมทั่วไประหว่างองค์ประกอบเหล่านี้ ยิ่งอะตอมของธาตุมีขนาดใหญ่เท่าใดก็ยิ่งมีปฏิกิริยามากขึ้น เนื่องจากแรงที่นิวเคลียสเก็บอิเล็กตรอนจากเปลือกสุดท้ายมีการเข้าถึงน้อยลงเรื่อยๆ สามารถสร้างพันธะไอออนิกด้วยฮาโลเจนได้ ตัวอย่างเช่น พันธะไอออนิกที่มีอยู่อย่างมากมายคือพันธะของโซเดียม-คลอรีน ทำให้เกิดโซเดียมคลอไรด์ NaCl.
กลุ่ม IIA: ธาตุอัลคาไลน์-เอิร์ธ:
ธาตุเหล่านี้ได้แก่: เบริลเลียม (Be), แมกนีเซียม (Mg), แคลเซียม (Ca), สตรอนเทียม (Sr), แบเรียม (Ba) และเรเดียม (Ra) พวกเขาไม่ได้เป็นอิสระในธรรมชาติ คาร์บอเนตและซิลิเกตมีอยู่ในปริมาณมาก พวกเขาเป็นอาร์เจนตินาสีขาวและผลึก รวมกับออกซิเจนได้ง่ายหากสัมผัสกับอากาศ ส่วนหนึ่งเป็นเพราะความจริงที่ว่าพวกเขามีอิเล็กตรอนสองตัวในเปลือกสุดท้ายซึ่งสอดคล้องกับความสามารถในการรับออกซิเจน แบเรียมเป็นองค์ประกอบที่มีการใช้งานมากที่สุดของกลุ่ม และร่วมกับแคลเซียม แบเรียมเป็นองค์ประกอบที่มีการใช้งานในอุตสาหกรรมมากที่สุดในกลุ่ม
กลุ่ม IIIA: ธาตุดิน:
กลุ่ม IIIA ประกอบด้วยธาตุโบรอน (B), อลูมิเนียม (Al), แกลเลียม (Ga), อินเดียม (ใน) และแทลเลียม (Tl) โบรอนเป็นองค์ประกอบที่ไม่ใช่โลหะ อะลูมิเนียมเป็นแอมโฟเทอริก (amphiprotic) นั่นคือสามารถทำหน้าที่เป็นกรดและเป็นเบสได้ และอีกสามธาตุเป็นธาตุโลหะ พวกมันมีอิเล็กตรอนสามตัวในเปลือกสุดท้าย ทำให้เกิดเวเลนซ์ +3 แม้ว่าบางครั้งแกลเลียมจะทำปฏิกิริยากับเวเลนซ์ +1 และ +2 ในสารประกอบบางชนิด โบรอนเป็นองค์ประกอบเดียวในซีรีส์นี้ที่สร้างไฮไดรด์ โบรอนและอะลูมิเนียมแบบคาร์ไบด์
กลุ่ม IVA: ตระกูลคาร์บอน:
องค์ประกอบที่เป็นตัวแทนของกลุ่ม IVA ได้แก่ คาร์บอน (C), ซิลิคอน (Si), เจอร์เมเนียม (Ge), ดีบุก (Sn) และตะกั่ว (Pb) สองตัวแรกมีลักษณะพื้นฐานที่ไม่ใช่โลหะ แต่เจอร์เมเนียม ดีบุก และตะกั่วเป็นโลหะ และยิ่งเลขอะตอมของพวกมันยิ่งสูง ยกเว้นซิลิคอน แต่ละองค์ประกอบมีความจุ +4 และ +2
สารประกอบในรูปแบบคาร์บอนและซิลิกอนซึ่งอะตอมขององค์ประกอบเชื่อมต่อกันด้วยอิเล็กตรอนร่วมคู่ คาร์บอนเป็นสาระสำคัญของสารประกอบอินทรีย์โดยเชื่อมโยงกับอะตอมของไฮโดรเจน ออกซิเจน ไนโตรเจน กำมะถัน และบางครั้งซิลิคอน
ซิลิคอนและเจอร์เมเนียมใช้สำหรับการผลิตชิ้นส่วนอิเล็กทรอนิกส์ เนื่องจากมีคุณสมบัติในการทำตัวเหมือนเซมิคอนดักเตอร์
Group VA: ตระกูลไนโตรเจน:
Group VA ประกอบด้วยธาตุ Nitrogen (N), Phosphorus (P), Arsenic (As), Antimony (Sb) และ Bismuth (Bi) ไนโตรเจนและฟอสฟอรัสเป็นอโลหะ สารหนูและพลวงเป็นเมทัลลอยด์ และบิสมัทเป็นโลหะ ธาตุเหล่านี้มีลักษณะเฉพาะโดยการก่อตัวเป็นไฮไดรด์ ซึ่งมีพิษน้อยที่สุดคือ แอมโมเนีย NH3. ไนโตรเจนสร้างกรดไนตริกHNO3ร่วมกับกรดไฮโดรคลอริกใน Agua Regia ซึ่งเป็นส่วนผสมที่สามารถละลายโลหะมีค่าได้ เช่น ทองคำและเงิน
ไนโตรเจนยังเกี่ยวข้องกับสารประกอบอินทรีย์กลุ่มใหญ่สองกลุ่มที่เรียกว่าเอมีนและเอไมด์ ซึ่งถือได้ว่าเป็นอนุพันธ์ของแอมโมเนีย NH3โดยการแทนที่ไฮโดรเจนด้วยสายโซ่ไฮโดรคาร์บอน
กลุ่ม VIA: ครอบครัวออกซิเจน:
ประกอบด้วยธาตุ ออกซิเจน (O) กำมะถัน (S) ซีลีเนียม (Se) เทลลูเรียม (เท) และพอโลเนียม (Po) ออกซิเจนเป็นสารออกฤทธิ์มากที่สุด และมีความสามารถในการสร้างพันธะโควาเลนต์ได้ง่าย เมื่อสัมผัสกับโลหะในสภาพแวดล้อมที่มีความชื้นสูง จะเกิดออกไซด์ มันสร้างโมเลกุลเรโซแนนซ์ที่เรียกว่าโอโซนซึ่งปกป้องโลกจากรังสียูวี
กลุ่ม VIIA: ฮาโลเจน:
ชื่อของมันหมายถึง "อดีตนักขาย" กลุ่มประกอบด้วยองค์ประกอบ Fluor (F), คลอรีน (Cl), โบรมีน (Br), ไอโอดีน (I) และ Astate (At) พวกมันมีอิเล็กตรอนเจ็ดตัวในเปลือกสุดท้าย ซึ่งช่วยให้พวกมันเป็นตัวรับอิเล็กตรอนหนึ่งตัว คุณภาพนี้ทำให้พวกเขาเชื่อมโยงกับองค์ประกอบของกลุ่ม IA สร้างเกลือไบนารี ฟลูออร์มีลักษณะเฉพาะด้วยการมีค่าอิเล็กโตรเนกาติวีตี้ที่ใหญ่ที่สุดของตารางธาตุทั้งหมด โดยมีค่า 4.0 ซึ่งเทียบเท่ากับซีเซียม ด้วยอิเล็กโตรเนกาติวีตี้ 0.7 คุณสมบัตินี้ช่วยให้มีความแข็งแรงในการดึงดูดอะตอมอื่น ๆ และให้ความสำคัญกับการสร้างพันธะกับ พวกเขา
กลุ่ม VIIIA: ก๊าซมีตระกูล:
เรียกอีกอย่างว่า Inert Gas Group ประกอบด้วยธาตุ Helium (He), Neon (Ne), Argon (Ar), Krypton (Kr), Xenon (Xe) และ Radon (Ra) เป็นองค์ประกอบที่มีการกำหนดค่าทางอิเล็กทรอนิกส์ทั้งหมด ดังนั้นจึงไม่สามารถตอบสนองภายใต้สภาวะปกติได้ ส่วนใหญ่จะใช้สำหรับป้ายการค้าแบบเรืองแสง โดยจะปล่อยแสงที่มองเห็นได้เมื่อมีกระแสไฟฟ้าตกกระทบบนป้ายดังกล่าว
กลุ่ม B: โลหะทรานสิชัน:
โลหะทรานซิชันถูกจัดกลุ่มเป็นสิบกลุ่มโดยแต่ละธาตุสามองค์ประกอบ ซึ่งรวมถึงตัวนำไฟฟ้าที่ดีที่สุด: เงิน (Ag), ทองแดง (Cu), ทอง (Au); ส่วนประกอบโครงสร้างที่ดีที่สุดสำหรับการก่อสร้างและวิศวกรรมในเมือง เหล็ก (Fe), ไทเทเนียม (Ti), อลูมิเนียม (Al), เซอร์โคเนียม (Zr), ทังสเตน (W); ส่วนประกอบตัวเร่งปฏิกิริยาที่ดีที่สุด: นิกเกิล (Ni), วานาเดียม (V), แพลตตินัม (Pt); และสารเคลือบหลัก ได้แก่ แคดเมียม (Cd), โครเมียม (Cr), สังกะสี (Zn) พวกเขามักจะจัดการกับความจุระหว่าง +1 ถึง +3 แต่องค์ประกอบอย่าง Chromium จะจัดการกับความจุ +2, +3, +6
ธาตุหายาก: Lanthanides และ Actinides:
พวกเขาถูกเรียกว่า Rare Earths เนื่องจากความขาดแคลนบนโลกใบนี้ ประกอบด้วยสองกลุ่ม: Lanthanides และ Actinides พบได้ในสองบรรทัดแยกกันของตารางธาตุ พวกมันทำงานโดยมีความจุ +3 โดยทั่วไปและมีแนวโน้มที่จะก่อตัวเป็นไฮดรอกไซด์ องค์ประกอบที่สำคัญที่สุดในหมู่พวกเขาคือซีเรียมซึ่งใช้ในการเตรียมโลหะผสมไพโรฟอริก (Alloy Mischmetalสำหรับหินสำหรับไฟแช็ค) ในท่อแก๊สเพื่อให้แสงสว่างและในการผลิตแว่นตาพิเศษที่ดูดซับรังสีอัลตราไวโอเลตและการแผ่รังสีความร้อน
ธาตุกัมมันตรังสีที่ทรงพลังที่สุด เช่น ยูเรเนียม (U) และพลูโทเนียม (Pu) เป็นส่วนหนึ่งของกลุ่มเหล่านี้ ที่ทำให้ไม่เสถียร ปล่อยพลังงานและสลายตัว สูญเสียอนุภาคอัลฟ่า (นิวเคลียสของ ฮีเลียม) ต่อมากลายเป็นองค์ประกอบที่ไม่เสถียรน้อยลงตามอนุกรมกัมมันตภาพรังสี
