ตัวอย่างโมเลกุลอินทรีย์และอนินทรีย์
เคมี / / July 04, 2021
เคมีทั่วไป เป็นศาสตร์ที่ศึกษา ทุกประเภทที่มีอยู่, และพวกเขา การเปลี่ยนแปลงภายใน มีการติดต่อระหว่างกันในลักษณะนี้
เคมีอินทรีย์ เป็นส่วนหนึ่งของวิชาเคมีทั่วไปที่กำหนดให้ศึกษาเรื่องที่มีองค์ประกอบหลักคือ องค์ประกอบคาร์บอน, แล้วไง มันเป็นส่วนหนึ่งของสิ่งมีชีวิต
เคมีอนินทรีย์ เป็นส่วนหนึ่งของวิชาเคมีทั่วไปที่มีหน้าที่ศึกษาวิชาที่เรียกว่า "แร่ธาตุ"ซึ่งเป็นส่วนหนึ่งของ ฉันไม่ได้อาศัยอยู่สิ่งแวดล้อม.
โมเลกุล เป็นสหภาพของ อะตอมต่างๆ ของธาตุต่างๆ สารเคมีเพื่อสร้างสารใหม่ที่มีคุณสมบัติเฉพาะ
ในวิชาเคมีทั่วไป องค์ประกอบ เป็น สารบริสุทธิ์ ที่ก่อตัวขึ้นโดย อะตอมชนิดเดียว. องค์ประกอบถูกจำแนกในตารางธาตุขององค์ประกอบทางเคมี
เหมือนเขา อะตอมเป็นหน่วยพื้นฐานของธาตุ, ที่ โมเลกุลเป็นหน่วยหลักของสารประกอบ ซึ่งเป็นสารที่มีพฤติกรรมทางเคมีเฉพาะตัว
สารประกอบ อาจเกิดขึ้นจากผลของ ปรากฏการณ์ทางธรรมชาติ, หรือ ถูกสร้างขึ้นในห้องปฏิบัติการ หรือใน โรงงานอุตสาหกรรมดังนั้นโมเลกุลจึงมีอยู่ทุกหนทุกแห่ง โมเลกุลอยู่ในแร่ธาตุ ในใบต้นไม้ ในอาหาร ในยา ในน้ำที่เราดื่ม ในอากาศที่เราหายใจ และแม้แต่ในมลภาวะของสิ่งแวดล้อม
เคมีทั่วไปแบ่งออกเป็น
เคมีอนินทรีย์ Y เคมีภัณฑ์ถึง องค์กรนไอคาดังนั้นโมเลกุลจึงสามารถจัดเป็นอนินทรีย์และอินทรีย์ได้โมเลกุลอนินทรีย์
ในเคมีอนินทรีย์ โมเลกุลส่วนใหญ่เกิดจาก formed การรวมกันของอะตอมของความจุเชิงบวกกับส่วนอื่นของความจุเชิงลบในพันธะไอออนิก. พันธะเหล่านี้ส่วนใหญ่เกิดขึ้นจากแรงแม่เหล็กไฟฟ้าระหว่างอะตอม ซึ่งเกิดจากการมีอยู่ของเวเลนซ์อิเล็กตรอน
ดังนั้นสารประกอบไอออนิกทั้งหมดจึงเกิดขึ้น เช่น เกลือ ออกซิซอลต์ กรด ออกซิยาซิด ออกไซด์ และไฮดรอกไซด์
โมเลกุลอนินทรีย์เป็นอิเล็กโทรไลต์
คุณสมบัติหลักของโมเลกุลไอออนิกคือเมื่อสัมผัสกับน้ำ H2หรือ, พวกมันถูกแยกออกเป็นสองส่วน: บวกและลบ สองส่วนนี้ อะตอมที่มีประจุไฟฟ้าหรือกลุ่มของอะตอม กระจัดกระจายอยู่ในน้ำ ถึงสารอนินทรีย์ที่สามารถแยกตัวในน้ำได้ เรียกว่าอิเล็กโทรไลต์
สารละลายที่เกิดจากน้ำและอนุภาคที่มีประจุบวกและลบเรียกว่า "สารละลายอิเล็กโทรไลต์". สารละลายประเภทนี้มีความสามารถในการนำกระแสไฟฟ้าได้ จึงถูกนำมาใช้ในเซลล์ไฟฟ้าเคมี เช่น แบตเตอรี่รถยนต์
โมเลกุลของกรดอนินทรีย์และอัลคาไลน์
ในกรณีของโมเลกุลอนินทรีย์เช่น กรด, ที่ ออกซิเอซิด และ ไฮดรอกไซด์ในเวลาเดียวกันที่แยกเป็นส่วนบวกและลบ พวกเขามีส่วนทำให้สารละลายมีคุณสมบัติที่เรียกว่าศักยภาพของไฮโดรเจน วัดเป็น ลอการิทึมลบของความเข้มข้นของไฮโดรเจนไอออน.
ศักยภาพของไฮโดรเจน (pH) เป็นตัวกำหนดว่าสารละลายมีสภาพเป็นกรดมากน้อยเพียงใด ในระดับ pH ซึ่งเปลี่ยนจากค่า 1 สำหรับความเป็นกรดสูงสุดเป็น 14 ซึ่งเป็นความเป็นด่างที่สมบูรณ์หรือความเป็นเบส ลักษณะของกรดจะเปลี่ยนจากค่า 1 ถึง 6 และความเป็นด่างอยู่ระหว่าง 8 ถึง 14 7 หมายถึง pH เป็นกลาง; ไม่เป็นกรดหรือด่าง ผลลัพธ์ของลอการิทึมลบของความเข้มข้น H + จะบอกเราว่าเราอยู่ตรงไหนของมาตราส่วน
ตัวอย่างของกรด:
กรดไฮโดรคลอริก: HCl: H+ + Cl-
กรดไฮโดรโบรมิก: HBr: H+ + บรา-
กรดซัลไฟริก: H2S: 2H+ + ส-2
กรดไซยาไฮดริก: HCN: H+ + CN-
กรดไอโอดไฮดริก: HI: H+ + ฉัน-
ตัวอย่างของ Oxyacids:
กรดกำมะถัน: H2SW4: 2H+ + SO4-2
กรดคาร์บอนิก: H2CO3: 2H+ + CO3-2
กรดไนตริก: HNO3: โฮ+ + ไม่3-
กรดฟอสฟอริก: H3ป4: 3H+ + ป4-3
กรดเปอร์คลอริก: HClO4: โฮ+ + ClO4-
ตัวอย่างของไฮดรอกไซด์:
โซเดียมไฮดรอกไซด์: NaOH: Na+ + OH-
แคลเซียมไฮดรอกไซด์: Ca (OH)2: Ca+ + 2OH-
แอมโมเนียมไฮดรอกไซด์: NH4OH: NH4+ + OH-
โพแทสเซียมไฮดรอกไซด์: KOH: K+ + OH-
แมกนีเซียมไฮดรอกไซด์: มก. (OH)2: มก+ + 2OH-
โมเลกุลอนินทรีย์ในปฏิกิริยาเคมี
เมื่อโมเลกุลอนินทรีย์มีส่วนร่วมในปฏิกิริยาเคมี กลไกปฏิกิริยาพื้นฐานและปฏิกิริยาง่าย ๆ สามารถมีได้สี่แบบ: การสังเคราะห์ การสลายตัว การแทนที่อย่างง่าย และการแทนที่สองครั้ง. นี่คือตัวอย่างของแต่ละ:
สังเคราะห์
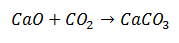
ปฏิกิริยาสังเคราะห์คือปฏิกิริยาหนึ่งที่ สองโมเลกุลมารวมกันเป็นผลิตภัณฑ์สุดท้ายที่ประกอบด้วยโมเลกุลเดียว. ในตัวอย่าง กรณีของแคลเซียมออกไซด์รวมกับคาร์บอนไดออกไซด์เพื่อสร้างโมเลกุลแคลเซียมคาร์บอเนต
การสลายตัว:

ปฏิกิริยาการสลายตัวเป็นหนึ่งในนั้น โมเลกุลเริ่มต้นแยกออกเป็นสองโมเลกุลที่เสถียรใหม่. นั่นคือกรณีของแคลเซียมไฮดรอกไซด์ที่แยกออกเป็นโมเลกุลของแคลเซียมออกไซด์และอีกโมเลกุลหนึ่งของน้ำ
การทดแทนอย่างง่าย:

ในปฏิกิริยาการแทนที่อย่างง่าย อะตอมของธาตุถูกแลกเปลี่ยนกับอะตอมหนึ่งของโมเลกุล. เช่นกรณีของโลหะสังกะสีที่วางตัวเองในตำแหน่งของไฮโดรเจนในไฮโดรเจนคลอไรด์ปล่อยมันออกมาและก่อตัวเป็นโมเลกุลของสังกะสีคลอไรด์
เปลี่ยนตัวสองครั้ง:
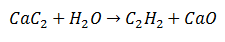
ในปฏิกิริยาการแทนที่สองเท่า อะตอมบางตัวของโมเลกุลเริ่มต้นสองตัวถูกแลกเปลี่ยนเพื่อสร้างโมเลกุลที่แตกต่างกันสองชนิดเป็นผลิตภัณฑ์. เช่นกรณีของแคลเซียมคาร์ไบด์ซึ่งผ่านการปล่อยคาร์บอนซึ่งจะรวมกับไฮโดรเจนจากน้ำเพื่อสร้างอะเซทิลีน แคลเซียมจะจับกับออกซิเจนเพื่อสร้างแคลเซียมออกไซด์เป็นผลิตภัณฑ์ที่สอง
โมเลกุลอินทรีย์
เคมีอินทรีย์คือเคมีคาร์บอนซึ่งหมายความว่าโมเลกุลอินทรีย์ทั้งหมดจะมีองค์ประกอบนี้อยู่ในโครงสร้างที่แตกต่างกัน
โมเลกุลอินทรีย์มีลักษณะเฉพาะโดย การมีอยู่อย่างต่อเนื่องของพันธบัตรโควาเลนต์ พันธะโควาเลนต์กับสิ่งที่ อะตอมสองอะตอมมารวมกันเพื่อแบ่งเวเลนซ์อิเล็กตรอนของพวกมันและทำให้ออคเต็ตของพวกมันสมบูรณ์.
นี่เป็นกรณีของคาร์บอนซึ่งจับกับอะตอมอื่นๆ โซ่ที่มีความยาวต่างกันมากถูกสร้างขึ้นจากอะตอมของคาร์บอนสองถึงหกสิบอะตอมและแม้กระทั่งโซ่เหล่านี้ พวกมันแตกแขนงกับสายโซ่อื่นๆ ที่มีความยาวเท่ากัน ทำให้เกิดโมเลกุลที่หลากหลายมาก โดยธรรมชาติ.
พันธะไอออนิกก็มีอยู่เช่นกัน แต่สิ่งเหล่านี้เกิดขึ้นในขั้นตอนกลางของกลไกปฏิกิริยาระยะยาวซึ่งจะสร้างโมเลกุลที่ต้องการ
โมเลกุลอินทรีย์ที่ง่ายที่สุด ได้แก่ คาร์บอนและไฮโดรเจน หลังเสร็จสิ้นความจุคาร์บอนที่ต้องการ
ในเคมีอินทรีย์ โมเลกุลสามารถเป็นแบบเส้นตรงหรือแบบอะลิฟาติก แบบกิ่ง แบบไซคลิก และแบบอะโรมาติก
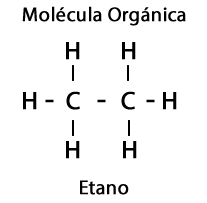
นอกจากนี้ ธาตุ ออกซิเจน ไนโตรเจน ซัลเฟอร์ และฟอสฟอรัส ยังเกี่ยวข้องกับโมเลกุลอินทรีย์ ซึ่งก่อให้เกิดความหลากหลายที่น่าประทับใจของกลุ่มฟังก์ชันสำหรับโมเลกุล
กลุ่มหน้าที่ในโมเลกุลอินทรีย์
Functional Groups คือกลุ่มของอะตอมตั้งแต่ 2 อะตอมขึ้นไป ซึ่งเมื่อเชื่อมกับสายคาร์บอน-ไฮโดรเจน จะเกิดเป็นสารเคมีชนิดต่างๆ กัน โดยมีพฤติกรรมเฉพาะ. ถัดไป เจ็ดประเภทหลักของโมเลกุลอินทรีย์จะแสดงรายการ พร้อมกลุ่มการทำงานตามลำดับ ตัวอักษร "R" ใช้เพื่อแสดงถึงห่วงโซ่คาร์บอนไฮโดรเจน
อัลคิลเฮไลด์ - รูปแบบ: R-X / Functional Group: ธาตุ Halogen (คลอรีน, โบรมีน, ไอโอดีน)

แอลกอฮอล์ - รูปแบบ: R-OH / กลุ่มฟังก์ชัน: -OH หรือ Hydroxyl.
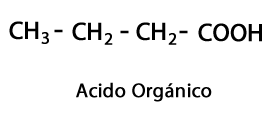
อัลดีไฮด์ - รูปแบบ: R-CHO / Functional Group: -CHO ซึ่งมักจะไปถึงจุดสิ้นสุดของห่วงโซ่
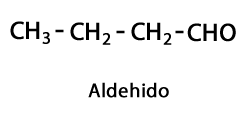
คีโตน - รูปแบบ: R-CO-R / Functional Group: -CO- หรือ Carboxy อยู่ตรงกลาง Carbon ของห่วงโซ่เสมอ
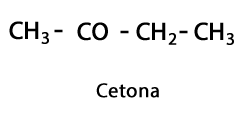
กรดอินทรีย์ - รูปแบบ: R-COOH / กลุ่มฟังก์ชัน: -COOH หรือคาร์บอกซิล ที่ส่วนท้ายของห่วงโซ่เสมอ
กรดเอสเทอร์ - รูปแบบ: R-COO-R / Functional Group: -COO- เป็นผลมาจากการรวมสายกรดกับสายคาร์บอนไฮโดรเจนอีกสายหนึ่ง
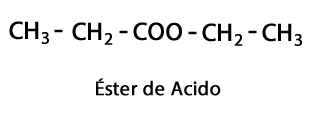
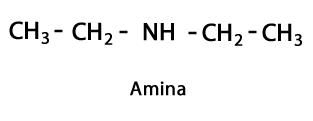
เอมีน - แบบฟอร์ม: R-NH2, R-NH-R, R-N-2R / กลุ่มฟังก์ชัน: -NH2, -NH-, -N = หรือ อะมิโน ซึ่งเป็นไนโตรเจนที่เสริมด้วยไฮโดรเจนในบริเวณที่ไม่มีสายโซ่คาร์บอน-ไฮโดรเจน ตามที่ระบุไว้สามารถไปปลายโซ่หรือตรงกลางได้ อะตอมไนโตรเจนสามารถมาพร้อมกับสายอินทรีย์หนึ่ง สอง หรือสามสายเพื่อสร้างโมเลกุลสุดท้าย เอมีนถือได้ว่าเป็นอนุพันธ์อินทรีย์ของแอมโมเนียNH3.
โมเลกุลอินทรีย์ในปฏิกิริยาเคมี
โมเลกุลอินทรีย์ ยิ่งสายคาร์บอน-ไฮโดรเจนของพวกมันยาวขึ้น ตำแหน่งหรืออะตอมก็ยิ่งมากขึ้นเท่านั้นที่จะมีส่วนร่วมในปฏิกิริยาเคมี
ส่วนใหญ่มักจะเพิ่มองค์ประกอบหรือโซ่ลงในคาร์บอนตัวใดตัวหนึ่งหรือส่วนหนึ่งของสายโซ่หลักถูกแยกออกเพื่อสร้างสารประกอบอินทรีย์ที่แตกต่างกัน
เนื่องจากปฏิกิริยาดังกล่าวช้า จึงใช้ตัวเร่งปฏิกิริยา ซึ่งเป็นสารเคมีเพื่อเร่งปฏิกิริยา ในบางกรณี ตัวเร่งปฏิกิริยาเป็นตาข่ายละเอียดของโลหะแพลตตินัม
ตัวอย่างของโมเลกุลอนินทรีย์
โซเดียมคลอไรด์ NaCl
โพแทสเซียมคลอไรด์ KCl
แอมโมเนียมคลอไรด์ NH4Cl
โซเดียมไนเตรต NaNO3
โพแทสเซียมไนเตรต KNO3
แอมโมเนียมไนเตรต NH4ไม่3
กรดกำมะถัน H2SW4
กรดฟอสฟอริก H3ป4
กรดฟอสฟอรัส H3ป3
กรดไฮโดรคลอริก HCl
กรดไอโอดไฮดริก HI
โซเดียมไฮดรอกไซด์ NaOH
โพแทสเซียมไฮดรอกไซด์ KOH
แอมโมเนียมไฮดรอกไซด์ NH4โอ้
แคลเซียมไฮดรอกไซด์ Ca (OH)2
แมกนีเซียมไฮดรอกไซด์มิลลิกรัม (OH)2
เฟอรัสไฮดรอกไซด์เฟ (OH)2
เฟอริกไฮดรอกไซด์เฟ (OH)3
เหล็กซัลไฟด์ FeS
เฟอร์รัสซัลเฟต FeSO4
เฟอริกซัลเฟตเฟ2(SW4)3
ตัวอย่างโมเลกุลอินทรีย์
กลูโคสซี6โฮ12หรือ6
มีเทน CH4
อีเทน C2โฮ6
อะเซทิลีน C2โฮ2
โพรเพน C3โฮ8
บิวเทน C4โฮ10
เอทานอล C2โฮ6หรือ
ซูโครส C12โฮ22หรือ11
เมทานอล CH4หรือ
กลีเซอรอล C3โฮ8หรือ3



