İdeal ve Gerçek Gazlara Örnek
Fizik / / July 04, 2021
bir Ideal gaz özellikleri gibi olandır Kapsanan Basınç, Sıcaklık ve Hacim, onlar tutar her zaman bir orantı ya da aralarındaki sürekli ilişki. Başka bir deyişle, davranışı, aşağıdaki gibi temsil edilen İdeal Gaz Yasasına uygundur:
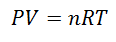
Bu formüle ulaşmak için La'dan başlıyoruz. Gaz Halinin Genel Yasası, bir işlemde her zaman gazın özellikleri arasında sabit bir ilişki olduğunu açıklar. Bahsedilen özellikler, Basınç gazın bulunduğu sistemde, Ses gazı işgal eden ve Sıcaklık gaz.
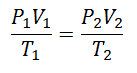
Er ya da geç daha basit bir ifade oluşturmaya karar verildi ve sabitliğe ifadeye eşlik edecek bir harf verildi:
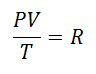
denirdi R faktöründe Evrensel Gaz Sabiti, ve değeri şudur:
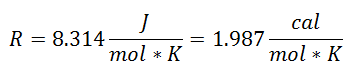
Ve Evrensel Gaz Sabiti gazın her bir molü için geçerli olduğundan, Gazın Mol Sayısı bir faktör olarak, işlem sırasında sistemde bulunan tüm maddeyi kapsayacak şekilde. Bu formdaki son denklemi zaten elde edeceğiz:
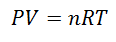
Yukarıdaki denklem İdeal Gaz Yasası, ve orta ve yüksek arasında bir sıcaklıkta olan gazlar için geçerlidir. Böylece, değişkenlerden herhangi biri, diğerleri belirlenerek hesaplanabilir.
İdeal Gazlar ve Gerçek Gazlar Arasındaki Fark
Bu İdeal Gaz Yasası geçerli değil bulunan gazlar için Düşük sıcaklık veya sıvı hale geldikleri noktaya yakın.
Düşük sıcaklıklar bir daha az parçacık hareketi gaz ve bunlar daha fazla yerleşecek ve tamamen dağıldıklarından farklı bir hacim işgal edecekler.
Ayrıca, aynı nedenle, bir egzersiz yapacaklardı. Sistem genelinde eşit olmayan basınç. Orantılılık bozulmaya başlayacak ve formül hesaplamalar için aynı geçerliliğe sahip olmayacaktır.
Bu durumda, Gerçek gazlar için denklemler kullanılmalıdır.
bir Gerçek Gaz özellikleri olan kişidir tam olarak ilişki kurmada uymuyorlar İdeal Gaz Yasasında olduğu gibi, bu özelliklerin hesaplanma şekli değiştirilmiştir.
Gerçek Gazlar İçin Durum Denklemleri
1.- Virial Denklem:
kaldığı bir gaz için Sabit sıcaklık, Basınç ve Hacim veya Basınç ve özgül hacim (gazın her bir kütle biriminin kapladığı hacim) arasındaki ilişki.
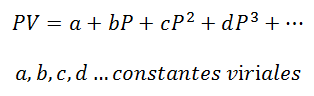
Virial sabitler, Sıcaklığa bağlı belirli değerlere sahip her bir gazın özellikleridir.
Sadece basınç ve hacim hesaplamaları yapılabilir; Sıcaklık önceden süreç gözlemlenerek belirlenir. Bu hesaplamalar için viral denklemin değişkenleri temizlenir:
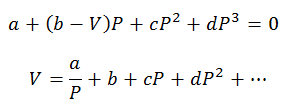
Denklemleri çözmek için virial sabitler özel tablolardan elde edilir.
2.- DenklemVan der Waals'ta:
Van der Waals Denklemi, Gerçek Gazın özelliklerini hesaplamak için kullanılan başka bir ifadedir ve Virial Denklemi gibi, sabitlerini de gerektirir:

Sabitler de tablolarda sorgulanır.
3.- DenklemKırmızı aslanch-Kwong:
Bu denklem, yüzlerce atmosfer gibi, neredeyse her sıcaklıkta ve ortalama basınçta, ancak çok yüksek olmadan gazlarla hesaplamalar yapmak için çok iyi çalışır.
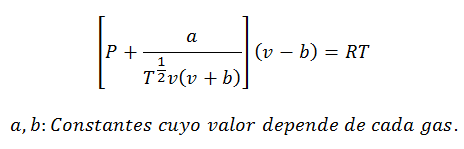
Sabitler de tablolarda sorgulanır.
Hesaplamalarınızı yapmak için Basınç, Sıcaklık ve Hacim'i temizleyebilirsiniz. Açıklıklar kalır:
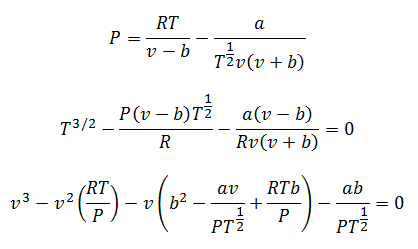
4.-Berthelot denklemi:
Bu denklem ile herhangi bir değişkeni hesaplamak mümkündür. Sadece iki farklı modu vardır: Düşük basınçlar ve yüksek basınçlar için.
Düşük basınçlar için:

Yüksek basınçlar için:
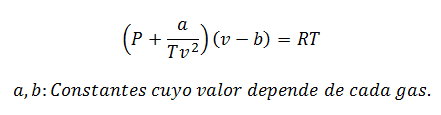
Sabitler de tablolarda sorgulanır.
5.-Sıkıştırılabilirlik Faktörü Denklemi
Bu denklem, İdeal Gaz Yasasının daha basit bir çeşididir; sadece Sıkıştırılabilirlik Faktörü adı verilen "z" faktörü eklenir. Bu faktör, mevcut olana bağlı olarak, Sıcaklığa, Basınca veya spesifik Hacme bağlı olarak Genelleştirilmiş Sıkıştırılabilirlik Faktörü Grafiği'nden elde edilir.
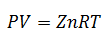
İdeal ve Gerçek Gaz Örnekleri
İdeal veya gerçek karakter olarak Gazın bulunduğu Basınç, Sıcaklık, Sınırlı bir liste oluşturmak mümkün değildir, bu nedenle elbette ideallik ve gerçeklikte bulunabilecek bir gaz listesi sunulur.
- Amonyak
- Soğutucu R134 (DiFluoroDiCloro Etan)
- Karbon dioksit
- Karbonmonoksit
- Oksijen
- Azot
- Hidrojen
- Nitrojen dioksit
- dinitrojen trioksit
- dinitrojen pentoksit
- dinitrojen heptoksit
- Kükürt dioksit
- kükürt trioksit
- Klor
- Helyum
- Neon
- Argon
- Kripton
- ksenon
- Metan
- Etan
- Propan
- Bütan
