Boyle Yasası Örneği
Fizik / / July 04, 2021
Gazların özelliklerini incelerken, Robert Boyle, bir yandan ve edme marriotteÖte yandan, deneylerini bilmeden ve bilmeden gazların sıkıştırılabileceğini ve hacimlerinin maruz kaldıkları basınçla orantılı olarak değiştiğini gözlemlediler.
Araştırmasını anlamak için, gazlarla ilgili bu çalışmada göz önünde bulundurulması gereken üç özellik olduğunu aklımızda tutmalıyız: sıcaklık, hacim ve basınç.
Sıcaklık: Deney koşulları altında bir gazın bulunduğu sıcaklıktır. Derece santigrat (° C) veya Kelvin veya mutlak sıfır (° K) olarak ifade edilebilir. Boyle Yasası durumunda, sıcaklığın değişmediği, yani sabit kaldığı kabul edilir.
Hacim: Bir gazın kapalı bir kap içinde kapladığı boşluktur. İlk olarak, bir gazın hacmi kabın hacmidir. Temsili olarak, kabın kapalı ve şırınga gibi bir pistonlu olduğu düşünülmektedir.
Basınç: Gazın piston içinden yaptığı basınçtır. Pistonun kapak olarak yerleştirildiği kapalı bir kapta basınç uygulanmadan atmosfer basıncında (1 de) olduğu kabul edilir.
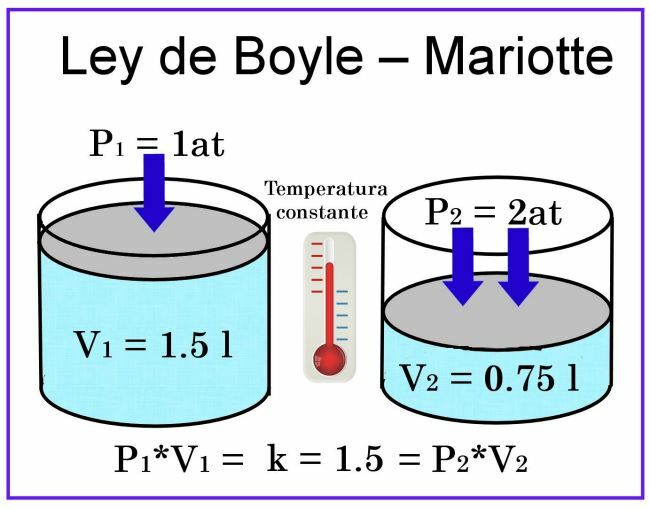
Boyle ve Mariotte gözlemlerinde, sıcaklığın sabit olduğu kabul edilir, bu nedenle ölçümü etkilemeyecektir.
Hacim ile ilgili olarak, örneğin 1 litre kapasiteli silindirik bir kap düşünürsek ve kapağı bir pistondur. kayar, hava ile dolu kabı kapatacak şekilde yerleştirirken, basınç 1, hacim ise 1 olacaktır. litre. Pistona 2 atmosferlik bir basınç uygulanırsa, gazın hacmi yarı yarıya, yani 0,5 litre veya 500 ml'ye düşecektir. Basınç 4 atmosfere çıkarsa, hacim çeyreğe, yani 0,25 litreye veya 250 ml'ye düşürülecektir.
Bu gözlemlere dayanarak, çağrı dile getirildi. Boyle Yasası: Sabit sıcaklıkta bir gazın hacmi, üzerine uygulanan basınçla ters orantılıdır.
Yani basınç arttığında hacim azalır ve basınç düştüğünde hacim artar.
Bu, bir gazın basıncı ile hacmi arasında değişen bir ilişki olduğunu ortaya çıkarır. bileşenlerden biri, diğeri aynı oranda değişir, ilişki sabit kalır, yani söyle:
P * V = k
P = Basınç
V = Hacim
k = basınç-hacim ilişkisinin sabiti
Bunu anlamak için, havayla dolu 2,5 litrelik bir kabımız olduğunu ve kapak pistonunun üzerindeki basıncın 1,5°C olduğunu varsayalım. Yani ilişkinizin sabiti:
P * V = k = (2.5) (1.5) = 3.75
Şimdi basıncı 3 atmosfere çıkarırsak, k'yi P basıncına böleriz ve şunu elde ederiz:
k / P = V
3,75 / 3 = 1,25 litre
Gördüğümüz gibi, basıncın iki katı uygulandığında, hacim orijinalin yarısıdır ve basınç-hacim ilişkisinin sabiti korunur. Bu şu şekilde ifade edilir:
V1P1 = V2P2 = k
Yani hacim 1 çarpı basınç 1'in çarpımı, hacim 2 çarpı basınç 2'nin çarpımına eşittir ve bu ilişki sabit kalır.
Boyle-Mariotte Yasası Örnekleri
örnek 1. 3,75 litre hacim kaplayan bir gazın, 2'deki basınçta, 3,5 at'lık bir basınç uygulandığında kaplayacağı hacmi hesaplayın.
V1 = 3,75 l
P1 = 2'de
V2 = ?
P2 = 3.5
V olarak1P1 = V2P2 = k
Sistemin sabitini hesaplıyoruz:
V1P1= k = (3,75) (2) = 7,5
V için çözüyoruz2:
V2 = k / P2 = 7.5 / 3.5 = 2.143 litre
Örnek 2. Bir gazın hacmi 2,25 litre ise, hacmi 1,75 litre ise hacmi 3,25 litre ise gaza uygulanan basıncı hesaplayınız.
V1 = 3,25 l
P1 = 1,75'te
V2 = 2,25 l
P2 = ?
Sistemin sabitini hesaplıyoruz:
V1P1= k = (3.25) (1.75) = 5.6875
P için çözüyoruz2:
P2 = k / V2 = 5,6875 / 2,25 = 2,53 en
Örnek 3. Bir gazın orijinal basıncını hesaplayın, eğer 4.5'te bir basınç uygularken, 1,4 litre hacim kaplar ve orijinal hacmi 2,2 litre ise.
V1 = 2,2 l
P1 = ?
V2 = 1,4 l
P2 = 4,5
Sistemin sabitini hesaplıyoruz:
V2P2= k = (1.4) (4.5) = 6.3
P için çözüyoruz2:
P1 = k / V1 = 6.3 / 2.2 = 2.863 en



