20 Приклади кислотних солей
Різне / / July 04, 2021
В неорганічна хімія солями називають сполуки, які отримують, коли а кислота його атоми водню замінені металевими катіонами (хоча іноді неметалевими катіонами, наприклад, катіоном амонію, NH4+). У конкретному випадку кислотні солі, водні кислоти частково заміщені, тобто принаймні один незаміщений водень залишається у складі солі. У тому, що вони відрізняються від нейтральні солі, де водні кислоти повністю заміщені.
ви виходите зазвичай утворюються внаслідок реакції між a кислота і a гідроксид (основа). У цих реакціях, як правило, основа втрачає свої гідроксильні групи (-OH), а кислота - їх. атоми водень (Н), утворюючи нейтральну сіль; але якщо кислота, про яку йде мова, зберігає принаймні один зі своїх атомів водню, змінюючи електричний заряд реакції, ми отримаємо кислотну сіль або гідровану сіль.
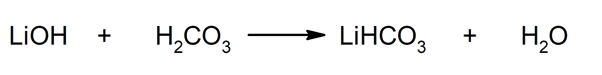
Так, наприклад, гідрокарбонат літію та вода отримуються в результаті реакції між гідроксидом літію та вугільною кислотою:
Номенклатура кислотних солей
Кислотні солі можна назвати відповідно до три типи Найпоширеніша номенклатура:
Приклади кислотних солей
- Бікарбонат натрію (NaHCO3). Він також називається гідрокарбонатом натрію (IV), це біла кристалічна тверда речовина, розчинна у воді, яку можна знайти в природі в штаті мінеральна або його можна виготовити в лабораторії. Це одна з найвідоміших кислотних солей і широко використовується у кондитерських, фармакологічних та йогуртових виробництвах.
- Бікарбонат літію (LiHCO3). Цю кислу сіль застосовували як захоплюючий агент для CO2 у ситуаціях, коли такий газ небажаний, як у північноамериканських космічних місіях "Аполлон".
- Калій дигідрофосфат (KH2PO4). Це кристалічна тверда речовина без запаху, розчинна у воді, широко використовується в різних галузях промисловості, таких як дріжджі їжа, хелатуючий агент, поживний зміцнювач та помічник у процесах бродіння.
- Бісульфат натрію (NaHSO4). Це кисла сіль, що утворюється при нейтралізації сірчаної кислоти. Він широко використовується промислово при переробці металів та чистячих засобів. Хоча він дуже токсичний для деяких голкошкірих, його використовують як добавку в корм для домашніх тварин та у виробництві ювелірних виробів.
- Сірководень натрію (NaHS). Це небезпечна сполука для обробки, оскільки вона є дуже корозійною та токсичною. Це може спричинити сильні опіки шкіри та пошкодження очей, оскільки він також є горючим.
- Гідрофосфат кальцію (CaHPO4). Він використовується як харчова добавка в крупи для великої рогатої худоби. Це тверда речовина, нерозчинна у воді, але здатна кристалізуватися при гідратації, споживаючи два молекули води.
- Гідрокарбонат амонію ([NH4] HCO3). Також відомий як "гідрокарбонат амонію", він використовується в харчовій промисловості як дріжджі хімічна, хоча вона має недолік уловлювання аміаку та надання їжі поганого смаку, якщо її використовувати в надлишок. Він також використовується в вогнегасниках, для виготовлення пігментів, а також для розширення гуми.
- Бікарбонат баріабо (Ba [HCO3]2). Це кисла сіль, яка при нагріванні може змінити свою реакцію виробництва і є дуже нестійкою, за винятком розчину. Він широко використовується в керамічній промисловості.
- Бісульфіт натрію (NaHSO3). Ця сіль надзвичайно нестійка, і в присутності кисню вона отримує сульфат натрію (Na2SW4), тому його використовують у харчовій промисловості як консервант та осушувач харчових продуктів. Це надзвичайний відновник і зазвичай використовується людиною, також використовується для фіксації кольорів.
- Цитрат кальцію (Змінного струму3[С6H5АБО7]2). Зазвичай відома як гірка сіль, вона використовується як харчовий консервант і як харчова добавка, коли вона пов’язана з амінокислотою лізином. Це білий кристалічний порошок без запаху.
- Монокальцій фосфат (Ca [H2PO4]2). Це безбарвна тверда речовина, яка отримується в результаті реакції гідроксиду кальцію та фосфорної кислоти, широко використовується як розпушувач або як добриво в сільськогосподарських роботах.
- Дикальцій фосфат (CaHPO4). Також відомий як моногідрофосфат кальцію, він має три різні кристалічні форми, які використовуються як добавка в їжу і присутні в зубних пастах. Крім того, він природним чином утворюється в сечокам’яній хворобі та так званому “камені в нирках”.
- Мономагній фосфат (MgH4P2АБО8). Це біла кристалічна сіль без запаху, частково розчинна у воді. Він використовується для консервування їжі, як підкислювач, як коректор кислотності або засіб при лікуванні борошна.
- Діацетат натрію (NaH [C2H3АБО2]2). Ця сіль використовується як ароматизатор і консервант під час їжі, що запобігає або затримує появу гриби та мікобактерії як у вакуумних упакованих продуктах, таких як м’ясні вироби, так і у борошняній промисловості.
- Бікарбонат кальцію (Ca [HCO3]2). Це гідрогенізована сіль, яка походить з карбонату кальцію, присутніх у таких мінералах, як вапняк, мармур та інші. Ця реакція передбачає наявність води та CO2, тому це може відбуватися спонтанно в печерах та печерах, багатих кальцієм.
- Фторид рубідієвої кислоти (RbHF). Цю сіль отримують в результаті реакції плавикової кислоти (водню та фтору) та рубідію, лужного металу. В результаті виходить токсична та їдка сполука, з якою слід поводитися обережно.
- Моноамоній фосфат ([NH4] H2PO4). Це водорозчинна сіль, що утворюється в результаті реакції аміаку та фосфорної кислоти. Зазвичай його використовують як добриво, оскільки воно дає грунту ґрунт поживні речовини азоту та фосфору, необхідних для росту рослин. Він також є частиною порошку ABC у вогнегасниках.
- Ортоборат водню цинку (Zn [ГБО3]). Це сіль, яка використовується як антисептик та як добавка у виробництві кераміки.
- Фосфат натрію (NaH2PO4). Застосовується здебільшого в лабораторіях, як «буфер» або буферний розчин, який запобігає різким змінам рН розчину.
- Калій гідрогенфталат (KHP). Також називаний "фталат калієвої кислоти", це тверда і стійка сіль у звичайному повітрі, тому його часто використовують як основний стандарт при вимірюванні рН. Він також корисний як буферний агент у хімічні реакції.
Слідуйте за:



