Визначення квантових чисел
Різне / / December 29, 2021
Концептуальне визначення
Квантові числа визначаються як цілі значення, які дозволяють нам визначити положення електрона всередині атома (у його додатковій ядерній зоні) і, таким чином, мати можливість ідентифікувати його.

Інженер-хімік
Квантові числа - це набір чисел, представлених літерами, які залежно від положення електрон до яких вони посилаються, приймають різні цінності в межах можливого діапазону. Зараз ми збираємося описати кожного з них, і ми побачимо приклади того, як вони застосовуються відповідно до електрона, який ми хочемо позначити.
Головне квантове число ("n")
Це тісно пов'язане з Енергія яким володіє електрон. Чим вище «n», тим вища енергія, оскільки це число пов’язане з розміром орбіталі. Математично це говорить нам про період, де знаходиться електрон, і, як ми знаємо з електронних конфігурацій елементів Періодична таблиця, їх фізично до семи рівнів енергії. Таким чином, "n" може варіюватися від одного до семи залежно від відстань до якого розташований електрон атома.
Вторинне або азимутальне квантове число ("ℓ")
Це число дозволяє ідентифікувати енергетичний підрівень, який займає електрон, тому, знову ж таки, чим вище азимутальне квантове число, тим вище енергія електрона. Математично «ℓ» представлятиме підрівні «s», «p», «d» і «f», які ми ідентифікуємо електронні конфігурації елементів періодичної таблиці. Ось чому він може приймати значення в діапазоні від нульовий до ("n" -1), де "n" - головне квантове число.
Наприклад, якщо n = 1, то ℓ може бути тільки нульовим, оскільки відповідає енергетичному підрівню «s». Тоді як, якщо n = 2, ℓ може мати значення як нуля, так і одиниці, оскільки ми можемо мати на увазі електрон підрівня «s» або підрівня «p» відповідно. Таким чином ми ідентифікуємо: ℓ = 0 для енергетичного підрівня «s», ℓ = 1 для енергетичного підрівня «p», ℓ = 2 для енергетичного підрівня «d» і ℓ = 3 для енергетичного підрівня «f».
Слід зазначити, що, згідно з «n», енергетичні підрівні «s», «p», «d» і «f» можуть додавати орбіталі і, отже, містити більше електронів. Наприклад, при n = 1 ℓ = 0 з одним «s» підрівнем і однією орбіталлю, яка може містити два електрони. Для n = 2, ℓ = 0 з підрівнем «s» або ℓ = 1 з підрівнем «p», який може містити три орбіталі та вміщувати шість електронів.
Для n = 3, ℓ = 0 з підрівнем «s» або ℓ = 1 з підрівнем «p», який може містити три орбіталі та вміщують шість електронів або ℓ = 2 з підрівнем "d", який може містити п'ять орбіталей і вміщувати десять електрони.
Нарешті, для n = 4, ℓ = 0 з підрівнем «s» або ℓ = 1 з підрівнем «p», який може містити три орбіталі та вміщувати шість електронів, або ℓ = 2 з підрівнем «p». підрівень «d», який може містити п'ять орбіталей і містити десять електронів або ℓ = 3 з підрівнем «f», який може містити сім орбіталей і будинок чотирнадцять електрони.
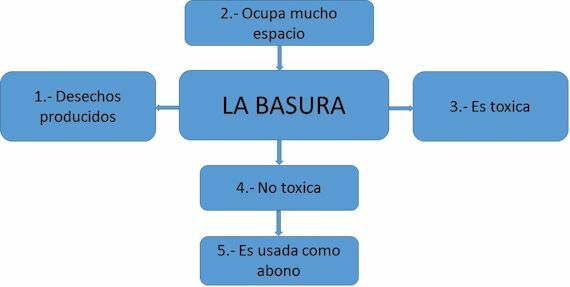
Якби ми хотіли представити ці орбіталі в просторі, їхня форма була б приблизно наступною:

Img: ChemistryGod
Магнітне квантове число ("m")
Він пов’язаний з орбіталем у просторі та з кількістю орбіталей, які має кожен підрівень. Тому значення, яке він приймає, коливається від «-ℓ» до «ℓ». Наприклад, для ℓ = 1 підрівень «p» містить до 3 орбіталей, тому «m» набуває таких значень, як -1, 0 або 1. Аналогічно, для ℓ = 2 підрівень "d" містить до 5 орбіталей, тому "m" може бути: -2, -1, 0, 1 або 2. Аналогічно це завершується для ℓ = 0 або ℓ = 4.
Спінове квантове число ("s")
Пов'язані з магнітними властивостями електрона і вони служать для виявлення напрямку обертання електрони, які розташовані в межах однієї орбіталі, оскільки кожен з них матиме різний знак. Тому "s" може приймати значення +1/2 або -1/2.
Давайте візьмемо Хлор як приклад, щоб визначити квантові числа в його електронах, розміщених на останньому енергетичному рівні. Для цього нам потрібно знати його електронну конфігурацію, яка становить: 1s2 2с2 2 п63s23п5. Електрони останнього рівня знаходяться на рівні 3, отже: n = 3. Тоді ℓ = 0 або ℓ = 1 для електронів, розміщених на підрівнях "s" або "p" відповідно.
Тепер для ℓ = 0 (3s2), m = 0 і s дорівнює +1/2 і -1/2 відповідно в кожному з електронів, що знаходяться там. Для ℓ = 1 (3п5), m = -1,0,1, тоді як s дорівнює +1/2 і -1/2 відповідно в кожному з електронів, що знаходяться там для m = -1 і 0, тоді як Орбіталь, позначена як m = 1, не є повною з двома електронами, тому ми повинні вибрати s = +1/2 або -1/2, залежно від того, що вибрано за умовою.
Теми квантових чисел