Концепція у визначенні ABC
Різне / / April 22, 2022
визначення поняття
Азеотропи – це суміші хімічних сполук з певним складом, які кипять при певних температурах. Основною характеристикою є те, що суміш веде себе так, ніби це єдина чиста речовина, зберігаючи її властивості та забезпечуючи легкість у використанні.

Інженер-хімік
Суміш може бути подана двома і більше компонентами та її композиція він однаковий як у рідкій фазі, так і в газовій фазі, це створює подібність з чистими речовинами. З цього легко зробити висновок, що ця суміш не може бути розділена на її компоненти за допомогою таких процесів, як фракційні перегонки, оскільки, як було зазначено вище, він збереже свої пропорції, ведучи себе так, як ніби це один компонент.
Ще одна особливість полягає в тому, що температура кипіння цієї суміші може бути вище, нижче або навіть дорівнювати температурі кипіння одного з її компонентів. Коли азеотроп закипить при а температура максимального кипіння, він відомий як максимальний азеотроп, а коли це відбувається при найнижчій можливій температурі, він відомий як мінімальний азеотроп. Це означає, що мінімальний азеотроп має нижчу температуру кипіння, ніж його чисті компоненти, і навпаки з максимальним азеотропом. Наприклад, у суміші метанол - бензол азеотроп мінімальний (0,61 бензол - 0,39 метанол у фракціях молярний) з температурою кипіння 58 °C, в резервуарі, де температура кипіння бензолу становить 80 °C, а температура кипіння метанолу 65°C
Мінімальний і максимальний азеотропи
Тепер… звідки береться азеотроп? Коли є відхилення від Закон Раульта, тобто тиск пари азеотропної суміші не пов’язаний безпосередньо з її молярною часткою, саме тоді виникає поняття азеотропної суміші. Ці відхилення виникають, коли компоненти значно притягуються або відштовхуються один від одного, тобто міжмолекулярні сили дуже різні в різних сполуках.
Якщо відхилення позитивне, ми маємо мінімальний азеотроп, а якщо відхилення негативне, ми маємо максимальний азеотроп. Щоб краще зрозуміти цю концепцію, давайте подивимося на деякі графіки:
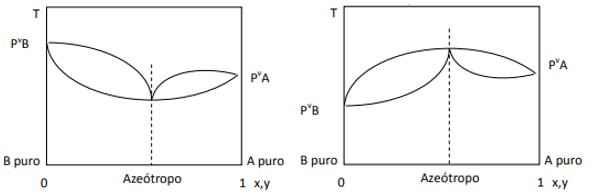
Тут ми помічаємо, що, якби суміш була ідеальною, згідно з законом Рауля, тиск пари чистих компонентів повинен бути з’єднаний прямою лінією, оскільки що ж, є відхилення від цього закону, що спричиняє утворення мінімальних і максимальних азеотропів, залежно від того, є більша чи менша спорідненість між компоненти. Коли відхилення від закону Рауля негативне, як на малюнку ліворуч, воно є мінімумом при діаграма тиску, але максимум на температурній діаграмі (отже, азеотроп максимуму). З іншого боку, якщо відхилення позитивне до закону Рауля, воно буде максимумом у тиску проти. складу, але мінімум на діаграмі температури в. склад (тут маємо мінімум азеотропу). Не плутайте діаграми тиск і. склад і температура в порівнянні з композиція.
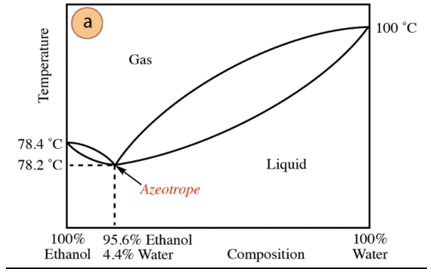
У випадку суміші етанол-вода існує мінімальний азеотроп, склад якого становить 95,6% етанолу і 4,4% води. Температура кипіння азеотропної суміші на 78,2 °С нижча, ніж у чистих компонентів. Отже, припустимо дистиляцію водно-етанольної суміші з високим вмістом води (близько до 100%). Отримати чистий спирт не вдасться, оскільки на кожній стадії перегонки будуть отримуватися більші фракції. етанолу, але ніколи не досягаючи 100%, він поступово наближатиметься до складу азеотропної суміші (найнижча точка під). Тому вона, як і вода, має тенденцію до утворення мінімуму азеотропів органічні сполуки (враховуючи тип міжмолекулярних сил, які взаємодіють), необхідно попередньо видалити воду з суміші, щоб отримати чисту сполуку. Або, як тільки азеотроп отримано, методи добування додаткової води.
Виходячи з вищесказаного, не випадково знайти алкоголь (у супермаркеті і АПТЕКА) на 95% є найдешевшим продуктом, який можна отримати. Щоб отримати чистий спирт, необхідно «розбити» азеотроп с техніка додаткові, такі як використання осушувачів або азеотропних перегонок. Азеотропна перегонка полягає в додаванні до суміші додаткового компонента, який діє шляхом захоплення та взаємодія з будь-яким з компонентів суміші (вищої спорідненості) можна видалити з суміші.
Теми в азеотропах