Приклад органічної хімії
Хімія / / July 04, 2021
Органічна хімія Це частина Загальної хімії, яка відповідає за дослідження та функціональну класифікацію хімічних сполук, структурним елементом яких є Вуглець, присутніх в достатку в жива матерія; таким чином створюється добре диференційований Всесвіт неорганічної хімії, присвячений хімічним сполукам, класифікованим як мінерали.
Атом Карбону має чотири електрони в останній оболонці своєї електронної конфігурації. Ця характеристика разом із характеристикою атомного радіуса дозволяє їй з’єднуватись ковалентними зв’язками з іншими атоми одного і того ж елемента, в численних ланцюгах, утворюючи велику різноманітність хімічних сполук стабільний.
Ви можете перевірити Ковалентні зв’язки.
Такі хімічні сполуки, крім атомів Карбону, що надають їм первісну структуру, містять атоми Гідрогену як основний компонент для валентності Карбону. Крім того, в цьому різноманітті сполук є такі, що впливають на атоми кисню, Азот, галогени, сірка і навіть фосфор, лужні та лужноземельні елементи та метали перехід. Залежно від того, хто бере участь у молекулі, це будуть фізичні та хімічні властивості кінцевої речовини.
органічні сполуки присутні по всьому жива матерія; сприяти та підтримувати всіх біологічні функції, на відміну від неорганічних або мінеральних речовин, які люди використовували в комерційних цілях, для експериментів або для виконання певних побутових завдань.
Історія органічної хімії
До 1828 р. Вже проводилося розмежування між органічною хімією та неорганічною хімією. Органічна речовина була пов'язана з творінням через "життєва сила", а до неорганічного з неживим, з мінералом. З огляду на ці концепції, не можна було очікувати отримання органічних сполук з неорганічних матеріалів у лабораторії.
Однак, у 1828 р. Фрідріх Фелер (1800-1882) вдалося приготувати органічну речовину, Сечовина CO (NH2)2, важливий продукт обміну речовин тварин, з неорганічних сполук. Лікування Свинець ціанат Pb (CNO)2 з Аміак NH3 отримати NH цианат амонію4CNO; Дійсно, ця сполука утворилася, але коли розчин кип’ятили для кристалізації ціанату амонію, він перетворювався на сечовину.
Ця хімічна зміна є прикладом Внутрішня перегрупування, в якому кількість або клас атомів у молекулі не змінюється, а лише їх порядок усередині неї. Ці типи перетворень дуже поширені в органічній хімії.
Відкриття Велера ініціювало відмову від теорії життєвих сил пізніше повністю відкидається, після чого слідує отримання багатьох інших органічних сполук в лабораторія. Незважаючи на це, кваліфікатори неорганічного та органічного існують, оскільки неорганічні сполуки відносяться до мінеральних продуктів а органічні сполуки, які насправді є сполуками вуглецю та водню та їх похідних, відносяться до типу, виробленого живими організмами.
Хоча закони загальної хімії однаково застосовуються до обох сполук, різні причини виправдовують та роблять цей поділ необхідним. Таким чином, органічні та неорганічні сполуки відрізняються різними властивостями, такими як: їх Розчинність переважні в органічних розчинниках (ефір, спирт, хлороформ та ін.) та у воді, відповідно, його Стабільність (органічні сполуки розкладаються при відносно низьких температурах), і Характер реакцій; для неорганічних сполук вони є іонними, простими і практично миттєвими, а для органічних сполук - ковалентними, складними і повільними.
Органічні сполуки
Відомі сполуки вуглецю з ланцюгами до дев'яноста атомів. ланцюги Атоми вуглецю можуть бути лінійні та розгалужені і мають одинарні ковалентні зв’язки або мають подвійні або потрійні зв’язки. Відомо, що понад 2500 сполук містять лише вуглець та водень (Вуглеводні).
Ізомерія органічних сполук
В неорганічних сполуках формула, як правило, являє собою одну сполуку; таким чином, існує лише одна речовина формули Н2SW4. Молекула Сірчаної кислоти містить два атоми Гідрогену, один із Сірки та чотири з Кисню, у специфічному та унікальному розташуванні. В органічних сполуках він є рідко таке трапляється. Так, наприклад, є два сполуки, які реагують на формулу С2H6Або етиловий спирт або етанол та диметиловий ефір.

Чим складніша молекула, тобто чим більше число атомів Карбону, тим більша кількість можливих ізомерів.
Аналіз органічних сполук
Аналіз органічної сполуки включає якісний аналіз, кількісний аналіз та Функціональний аналіз. У разі припущення, що сполука знаходиться в нечистому стані, вона попередньо очищається Кристалізація, Дистиляція, Сублімація, Видобутоктощо Про критерій чистоти можна судити, виходячи з його фізичних констант, таких як температура плавлення, температура кипіння, щільність, розчинність, кристалічна форма, показник заломлення тощо.
якісний аналіз Це перевіряється шляхом дослідження наявності елементів, що входять до складу сполуки, особливо вуглецю, водню та азоту, а іноді і галогенів, сірки та фосфору.
кількісний аналіз Він здійснюється з використанням в якості основи методів, що використовуються для якісного аналізу. Початковою точкою є певна кількість речовини, яка піддається горінню, а вуглекислий газ збирається і зважується. вуглецю та водяної пари, що утворюються для розрахунку відсоткового вмісту вуглецю та водню в з'єднання. Результати кількісного аналізу полегшують обчислення емпірична формула, хоча молекулярну формулу можна знайти лише після визначення молекулярної маси речовини. Але проблема ще не вирішена, оскільки одна і та ж молекулярна формула може відповідати різним ізомерам.
Класифікація органічних сполук
За своєю будовою органічні сполуки поділяються на сполуки аліфатичний, ароматичний Y гетероциклічний. Аліфатичні сполуки відносяться до метану СН4, є відкритими ланцюгами, за винятком циклопарафінів, і своєю назвою зобов'язані тому, що тваринні та рослинні жири належать до цієї групи.
ароматичні сполуки, замкнутий ланцюг, тісно пов’язаний з бензолом, C6H6, і своєю назвою вони зобов’язані тому, що багато з них мають запашні, приємні запахи.
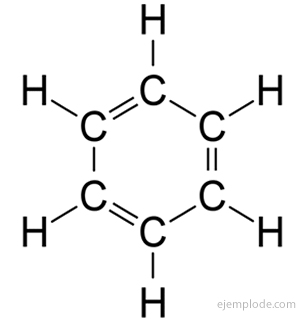
Бензольне кільце
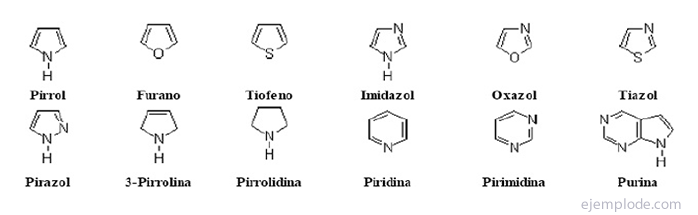
гетероциклічні сполуки Вони є сполуками із замкнутим ланцюгом, у кільці яких є елемент, відмінний від вуглецю.
За своєю конституцією вони:
Вуглеводні, який, у свою чергу, через тип посилань, які він має, класифікується як Алкани, Алкени Y Алкіни. Крім того, до цієї категорії належать циклоалкани, бензол та їх похідні, що складаються лише з вуглецю та водню.
Гетероциклічні сполуки
Галогеновані похідні:R-X
Нітросполуки:R-NO2
Сульфокислоти:R-SO3H
Нітрили (АБО алкілціаніди) та ізонітрили:R-CN та R-NC. Вони відрізняються тим, як атом Нітрогену зв’язаний у молекулі.
Спирти:R-OH
Феноли: З'єднання на основі основи, що складається з бензольного кільця з доданою гідроксильною групою.

Ефіри:R-O-R
Меркаптани: R-SH
Тіоетери:R-S-R
Тіокислоти:R-COSH
Альдегіди:R-CHO
Кетони:R-CO-R
Карбонові кислоти:R-COOH
Ви виходите:R-COOM (М для металу)
Ефіри: R-COO-R
Ангідриди: R-CO-O-OC-R
Аміни:R-NH2, R-NH-R, 2R-N-R
Вуглеводи типу Альдоза:-CHOH-CHOH-CHO
Вуглеводи кетозного типу:-CHOH-CO-CH2О
Металоорганічні сполуки:R-M-R
Галогеніди металу-алкілу:R-MX (також відомий як реактиви Гриньяра)


