Приклад хімічних елементів
Хімія / / July 04, 2021
Хімічний елемент це чиста речовина, що складається з атомів одного типу, у свою чергу сформований за кількістю протонів і нейтронів в ядрі, і кількість електрони на своїх орбіталях. Деякі знаходять природним шляхом, інші шляхом утворення молекул сполуки, а треті були створені шляхом виконання лабораторних процедур. Всі хімічні елементи складають матерію всього Всесвіту і підтримують існування та функціонування людського тіла.
Кожен елемент має характеристики та поведінку, які надають йому відмінності та роблять його унікальним, але в той же час він представляє схожість із групою елементів у прояві, який вони мають у Всесвіт. З цієї причини існує Періодична система хімічних елементів, яка розглядає ці подібності, щоб послідовно групувати елементи та полегшити вивчення їх властивостей.
Атомний номер Елемента
Атом несе в ядрі ряд протонів, що супроводжуються такою ж кількістю нейтронів. До цього числа Його називають атомним числом, представлений як Z для академічних цілей та з літератури. Для кожного Елемента це число буде унікальним. Не існує двох Елементів з однаковим атомним номером. Періодична система також зосереджує увагу на цьому критерії їх упорядкування.
Символ елемента
За часів Алхімії, які охоплюють приблизно рік від 400 до 1000 р. Н. Е. К., алхіміки записували свої експерименти, призначаючи символи елементам. Це були прості символи, зроблені з геометричними фігурами, щоб зобразити окремий елемент та вивчені перетворення.
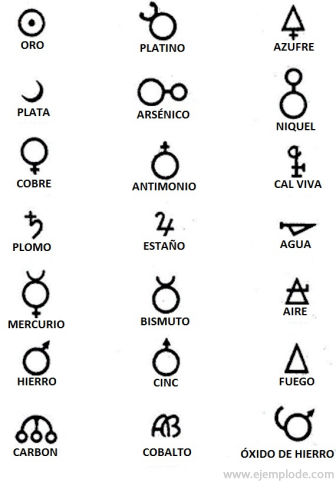
Деякі приклади алхімічних символів із назвою елемента або сполуки, яку вони представляли.
В епоху сучасної хімії Елементи все ще представлені символами, в даному випадку буквами, що посилаються на їх назву латинською або англійською мовами.
Наприклад:
Символом натрію є Na, своєю латинською назвою Натрій
Символом золота є Au, своєю латинською назвою Аурум
Символом срібла є Ag, своєю латинською назвою Аргентум
Символом Мідь є Cu, своєю латинською назвою Cuprum
Символом Сурма є Sb, своєю латинською назвою Стибій
Символом заліза є Віра, своєю латинською назвою Ферум
Символом Меркурія є Рт. Ст, своєю латинською назвою Hydrargyrum, що означає "рідке срібло"
Символом Калій є К, своєю латинською назвою Калій
Групи хімічних елементів:
Періодична система хімічних елементів класифікує їх за групами: групи А та групи В. Групи А - це вісім, які містять Елементи Лужна, Лужно-земляний, Терреос, три родини Елементів, голова яких визначає назву родини: Сім'я вуглецева, Сім'я азоту, Сірчана Сім'я, Галогени та Благородні гази. Групи В складаються з усіх Перехідні метали і Рідкісні Землі, які також є двома великими сім'ями: Лантаніди Y Актиніди.
Група IA: Лужні елементи:
Серія лужних елементів складається з Гідрогену (H), Літію (Li), Натрію (Na), Калію (K), Рубідію (Rb), Цезію (Cs) та Францію (Fr). Всі вони мають електронну конфігурацію таку, що в останній оболонці вони мають електрон. Їх назва пов’язана з тим, що при контакті з водою вони реагують, утворюючи луги або гідроксиди. Це загальна поведінка між цими елементами. Чим більший атом елемента, тим він більш реактивний, оскільки сила, з якою ядро утримує електрон від останньої оболонки, має все менше охоплення. Вони здатні утворювати іонні зв’язки з галогенами. Наприклад: Іонний зв’язок, який має велику кількість, - це натрій-хлор, утворюючи хлорид натрію NaCl.
Група IIA: Лужно-земні елементи:
Це елементи: берилій (Be), магній (Mg), кальцій (Ca), стронцій (Sr), барій (Ba) і радій (Ra). Вони не є вільними в природі; з іншого боку, його карбонати та силікати існують у відносному достатку. Вони аргентинські білі та кристалічні. Вони легко поєднуються з киснем, потрапляючи на повітря. Це частково пов’язано з тим, що вони мають два електрони в останній оболонці, що узгоджується з рецепторною здатністю кисню. Барій є найактивнішим елементом групи, і разом із кальцієм вони мають найбільш промислове застосування в групі.
Група IIIA: Елементи Землі:
Група IIIA включає елементи бор (B), алюміній (Al), галій (Ga), індій (In) та талій (Tl). Бор - неметалевий елемент, алюміній - амфотерний (амфіпротний), тобто він здатний діяти як кислота і як основа; а інші три - металеві елементи. Вони мають три електрони в останній оболонці, утворюючи валентність +3, хоча іноді Галій діє з валентністю +1 і +2 в деяких його сполуках. Бор - єдиний елемент цієї серії, який утворює гідриди. Бор і алюміній утворюють карбіди.
Група IVA: Вуглецева сім’я:
Репрезентативними елементами групи IVA є вуглець (C), кремній (Si), германій (Ge), олово (Sn) та свинець (Pb). Перші два за своїми характеристиками є принципово неметалевими, але германій, олово та свинець є металевими, і тим більше, чим вищий їх атомний номер. За винятком кремнію, кожен елемент має валентності +4 і +2.
Вуглець і кремній утворюють сполуки, в яких атоми елементів з'єднані парами спільних електронів. Вуглець - це суть органічних сполук, пов’язаних з атомами Гідрогену, Оксигену, Азоту, Сірки, а іноді і Кремнію.
Кремній та германій використовуються для виготовлення електронних компонентів, оскільки мають властивість поводитися як напівпровідники.
Група VA: Сім'я азоту:
Група VA включає елементи Нітроген (N), Фосфор (P), Миш'як (As), Сурма (Sb) та Вісмут (Bi). Азот і Фосфор - неметалеві, Миш'як та Сурма - металоїди, а Вісмут - метал. Ці елементи характеризуються утворенням гідридів, з яких найменш токсичним є аміак NH3. Азот утворює азотну кислоту HNO3, що бере участь разом із соляною кислотою в регіоні Агуа-Регія, суміш, здатна розчиняти такі дорогоцінні метали, як золото та срібло.
Азот також бере участь у двох великих групах органічних сполук, званих амінами та амідами, які можна вважати похідними аміаку NH3, шляхом заміщення водню вуглеводневим ланцюгом.
Група VIA: Киснева родина:
Складається з елементів Кисень (O), Сірка (S), Селен (Se), Теллур (Te) та Полоній (Po). Кисень є найбільш активним і має здатність легко утворювати ковалентні зв’язки. Контактуючи з металами в середовищі з високою вологістю, він утворює оксиди. Він утворює резонансну молекулу, яка називається озон, яка захищає планету від ультрафіолетового випромінювання.
Група VIIA: Галогени:
Його назва означає "Формувальники продажів". Група складається з елементів Фтор (F), Хлор (Cl), Бром (Br), Йод (I) та Астат (At). Вони мають сім електронів в останній оболонці, що дозволяє їм бути рецепторами для одного електрона. Ця якість робить їх зв’язаними з елементами групи IA, утворюючи бінарні солі. Для фтору характерна найбільша електронегативність у всій Періодичній системі зі значенням 4,0, його аналогом є цезій, з електронегативністю 0,7. Ця властивість дозволяє йому мати силу залучати інші атоми і надавати пріоритет утворенню зв'язку Вони.
Група VIIIA: Благородні гази:
Також її називають групою інертних газів, вона складається з елементів Гелій (He), Неон (Ne), Аргон (Ar), Криптон (Kr), Ксенон (Xe) та Радон (Ra). Вони є елементами, які мають всю свою електронну конфігурацію, тому вони не здатні реагувати в звичайних умовах. Вони використовуються в основному для світлових комерційних знаків, що випромінюють видиме світло, коли на них падає електричний струм.
Групи B: Перехідні метали:
У десять груп по три елементи в кожній перехідні метали групуються. До них належать найкращі електричні провідники: срібло (Ag), мідь (Cu), золото (Au); кращі структурні компоненти для міського будівництва та інжинірингу; Залізо (Fe), титан (Ti), алюміній (Al), цирконій (Zr), вольфрам (W); найкращі компоненти каталізатора: нікель (Ni), ванадій (V), платина (Pt); та основні інгредієнти покриття: кадмій (Cd), хром (Cr), цинк (Zn). Зазвичай вони обробляють валентності від +1 до +3, але такі елементи, як Chromium, обробляють валентності +2, +3, +6.
Рідкісні землі: Лантаніди та актиніди:
За їх нестачу на планеті їх називають рідкісними землями. Вони складаються з двох груп: лантанідів та актиноїдів. Вони знаходяться в двох окремих рядках Періодичної системи. Вони працюють з валентністю +3, як правило, і, як правило, утворюють гідроксиди. Найважливішим елементом серед них є церій, який використовується при приготуванні пірофорних сплавів (сплав Мішметал, для каменів для запальничок), у газових шлангах для освітлення та при виготовленні спеціальних окулярів, що поглинають ультрафіолетові промені та теплову радіацію.
Найпотужніші радіоактивні елементи, такі як уран (U) та плутоній (Pu), входять до цих груп. що, враховуючи їх нестабільність, виділяють енергію і розпадаються, втрачаючи альфа-частинки (ядра Гелій). Пізніше вони стають менш нестабільними елементами, згідно радіоактивного ряду.

