Приклад металевого зв’язку
Хімія / / July 04, 2021
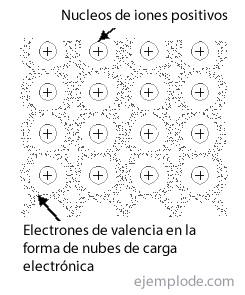
Металевий ланка - це спосіб, яким атоми металу вдається зустрітися в кристалічна структура, стабільний, використовуючи хмари його електроніві незалежно від винятковості іонних або ковалентних зв’язків проявлятись як чисті речовини. Названий Мережа до групи або розташування металевих ланок.
Більшість металів кристалізується у трьох типах компонування: Кубічні мережі, орієнтовані на тіло, Кубічні мережі, орієнтовані на обличчя Y Компактні шестикутні мережі.
У в тіло по центру, кожен атом металу оточений 14 сусідами, а в інших два залишилися на 12. Якщо ви спробуєте вирішити зв'язок таких структур, ви одразу виявите проблему електронної недостатності. Таким чином, у випадку з літієм з одним валентним електроном і 14 близькими сусідами, слід пояснити, яким є цей елемент оточений такою великою кількістю атомів, і все ж він утворює кристал, досить стійкий, щоб мати температуру плавлення 186 ° C. Те саме відбувається з іншими металами.
Швейцарський фізик Фелікс Блох в 1928 р. він запропонував квантово-механічну теорію для пояснення зв'язку атомів у металевих кристалах. У цьому
Теорія смуг всі електрони, присутні в атомі на повністю заповнених енергетичних рівнях, розглядаються по суті розташовані, тобто пов'язаний з атомами, з якими вони пов'язані. З іншого боку, розглядаються валентні електрони на незаповнених енергетичних рівнях безкоштовно, і вони рухаються в потенційному полі, яке поширюється на всі атоми, присутні в кристалі.атомні орбіталі цих вільних електронів в атомі може перекриття з іншими, щоб походити делокалізовані молекулярні орбітали які утворюють зв'язок між усіма присутніми атомами і які відомі під назвою Орбітали проведення.
енергетичні рівні електронів в ізольованих атомах стримано і взагалі добре розташовані. Але наявність інших атомів у кристалі впливає на ці рівні, перетворюючи кожен рівень в а смуга рівня число яких дорівнює кількості атомів, присутніх у структурній сукупності. Якщо це число велике, кожен ізольований рівень становить практично a безперервна смуга. Крім того, коли простір між початковими рівнями та між атомами в металі великий, тоді діапазони, що походять з ранніх електронних рівнів, відокремлені один від одного для енергетичні розриви значний. Коли рівні та відстані невеликі, смуги є перехрестити і перекрити кожен.
Ця теорія забезпечує наступний опис електронної структури даного металу. A твердий метал вважається, що має смуги електронів відокремлені один від одного енергетичні розриви. Крім того, ці смуги іноді повністю заповнені локалізованими електронами, або вони частково заповнені вільними електронами, молекулярні орбіталі яких поширюються на всі атоми кристала.