50 أمثلة على الألدهيدات والكيتونات
أمثلة / / November 06, 2023
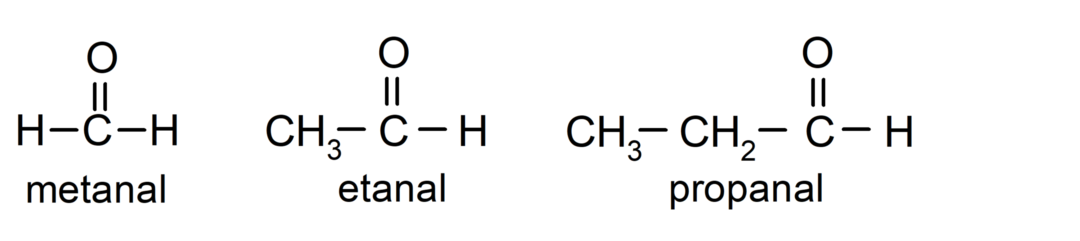
ال الألدهيدات نكون مركبات العضوية التي تحتوي في بنيتها على مجموعة كربونيل وظيفية (= C = O) مرتبطة بسلسلة كربون وذرة هيدروجين. على سبيل المثال: الميثانال (يُسمى أيضًا الفورمالديهايد)، والإيثانال (يُسمى أيضًا الأسيتالديهيد)، والبروبانال (يُسمى أيضًا البروبالديهيد).
ال الكيتونات وهي مركبات عضوية تحتوي في بنيتها على مجموعة كربونيل مرتبطة بذرتي كربون. على سبيل المثال: البروبانون (ويسمى أيضًا الأسيتون)، والبيوتانون، و2-بنتانون.
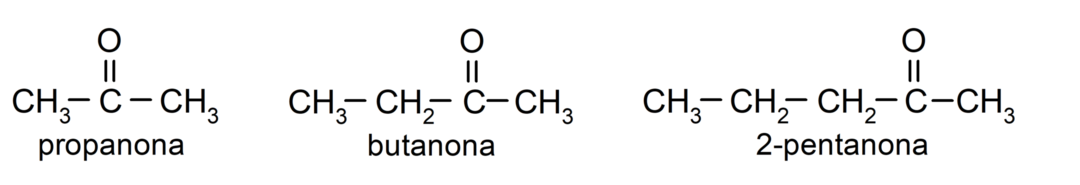
الاختلافات بين الألدهيدات والكيتونات
الاختلافات الرئيسية بين الألدهيدات والكيتونات هي:
- تحتوي الألدهيدات في بنيتها على مجموعة وظيفية من الكربونيل تقع في أحد الأطراف الطرفية، بينما تحتوي الكيتونات على مجموعة الكربونيل الموجودة في مواضع غير طرفية من جزئها بناء.
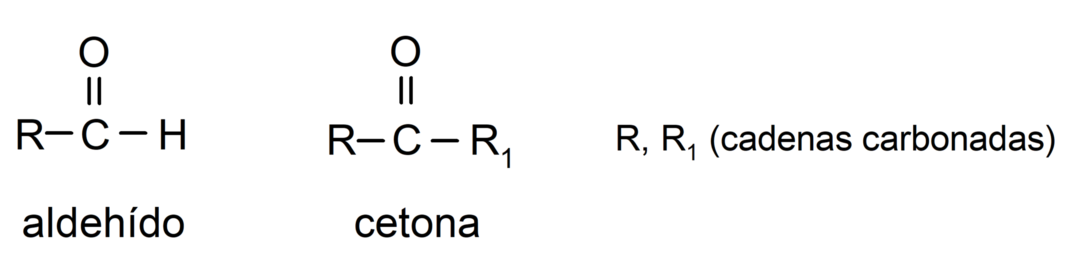
- تتأكسد الألدهيدات عن طريق التفاعل مع كاشف تولنز لتكوين الفضة المعدنية. كما أنها تتأكسد ضد كاشف بنديكت، وتشكل أكسيد النحاسوز. لا تتأكسد الكيتونات بواسطة أي من الكاشفين.
- يتم اختزال الألدهيدات إلى كحولات أولية، بينما يتم اختزال الكيتونات إلى كحولات ثانوية.
الخصائص الفيزيائية
الخصائص الفيزيائية للألدهيدات
تتنوع الخصائص الفيزيائية للألدهيدات بشكل كبير لأنها تعتمد على تكوين سلسلة الكربون المرتبطة بمجموعة الكربونيل.
البعض يكونون:
- الألدهيدات الأكثر قابلية للذوبان في الماء هي تلك الأصغر حجمًا، مثل الميثانال والإيثانال.
- الألدهيدات المتطايرة لها روائح نفاذة وحتى مزعجة.
- مجموعة الكربونيل تعطيهم قطبية.
- وعادة ما تكون نقاط غليانها أعلى من المركبات الكيميائية ذات الحجم الجزيئي المماثل.
الخصائص الفيزيائية للكيتونات
تعتمد الخصائص الفيزيائية للكيتونات على كيفية تكوين سلسلة الكربون المرتبطة بمجموعة الكربونيل.
- العديد من الكيتونات لها روائح لطيفة.
- تعتمد قابليته للذوبان في الماء على حجم سلسلة الكربون المرتبطة بمجموعة الكربونيل. كلما كانت سلسلة الكربون أصغر، كلما كان الكيتون أكثر قابلية للذوبان في الماء.
- تمنحهم مجموعة الكربونيل قطبية ملحوظة.
- لديهم نقاط غليان عالية إلى حد ما مقارنة بالمركبات الكيميائية ذات الحجم الجزيئي المماثل.
الخواص الكيميائية
الخواص الكيميائية للألدهيدات
من بين الخصائص الكيميائية للألدهيدات يمكننا أن نجد:
يتم أكسدتها لتكوين حمض الكربوكسيل المقابلأي أن الحمض المتكون سيكون له نفس عدد ذرات الكربون في سلسلة الكربون مثل الحمض ألدهيد الذي أدى إلى ذلك. على سبيل المثال:
- الأكسدة باستخدام كاشف تولنس (مركب الفضة الأمونيا في المحلول الأساسي، [Ag (NH3)2]+) من الإيثانال ينتج حمض الإيثانويك والفضة المعدنية.
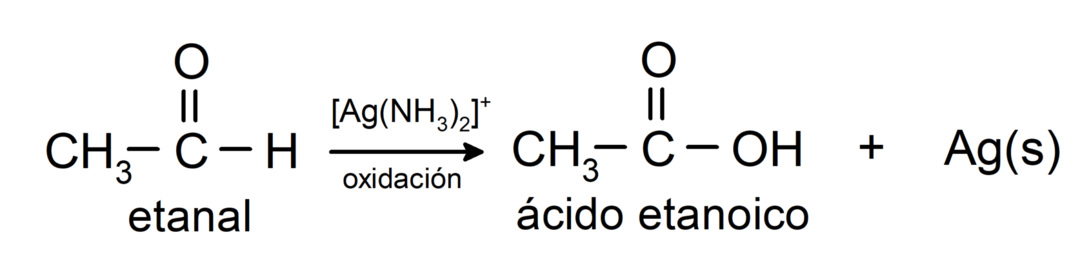
- الأكسدة مع كاشف بنديكت (محلول قلوي من كبريتات النحاس) من الإيثانال تنتج حمض الإيثانويك وأكسيد النحاسوز.
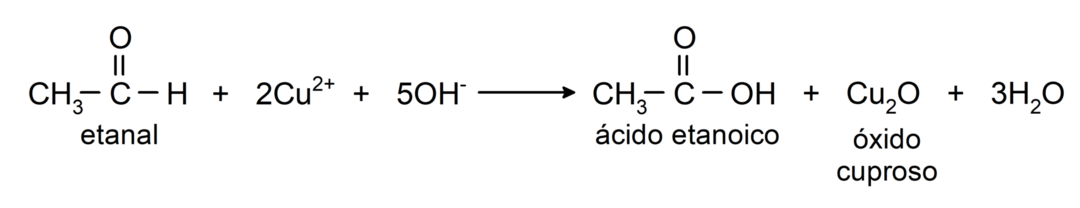
أنها تخضع لتفاعلات الإضافة النوويةأي إضافة النيوكليوفيل إلى مجموعة الكربونيل. على سبيل المثال:
- إضافة حمض الهيدروسيانيك لتكوين سيانوهيدرين أو سيانوهيدرين.
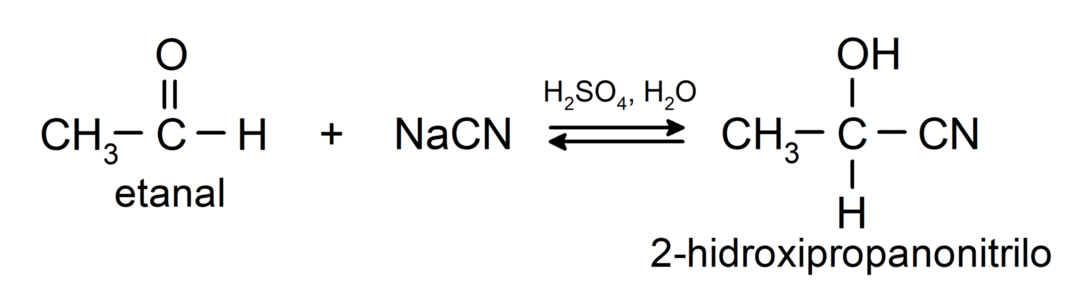
- في وجود الأحماض اللامائية، تضاف الكحولات إلى مجموعة الكربونيل من الألدهيدات لتكوين الأسيتال والنصف الأسيتال.
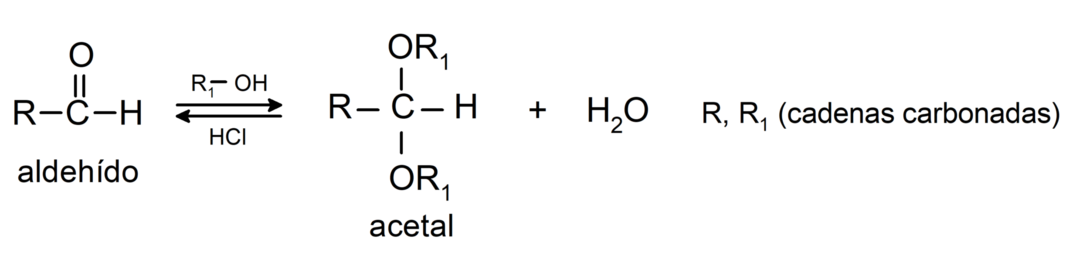
أنها تخضع لتفاعلات تكثيف ألدول. في هذه التفاعلات، يحدث اتحاد الألدهيدات في وجود هيدروكسيد الصوديوم (NaOH) و مركب كيميائي ويسمى الناتج ألدول. على سبيل المثال:
- تفاعل تكثيف الإيثانال في وجود NaOH المخفف.
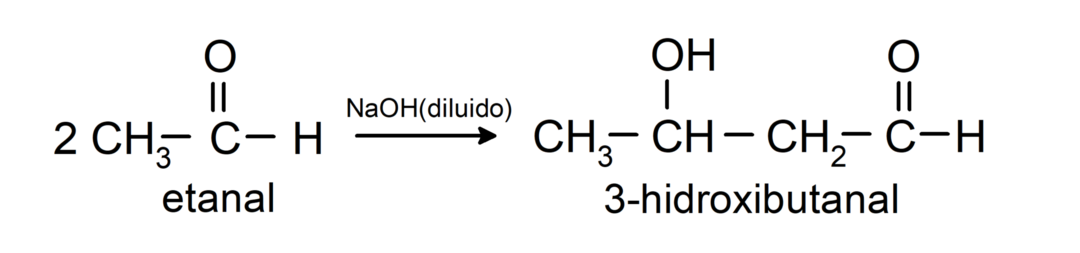
يتم تحويلها إلى كحولات أولية. يمكن اختزال الألدهيدات إلى كحولات أولية عن طريق الهدرجة الحفزية أو عن طريق الاختزال باستخدام بوروهيدريد الصوديوم (NaBH).4) وهيدريد ألومنيوم الليثيوم (LiAlH4).
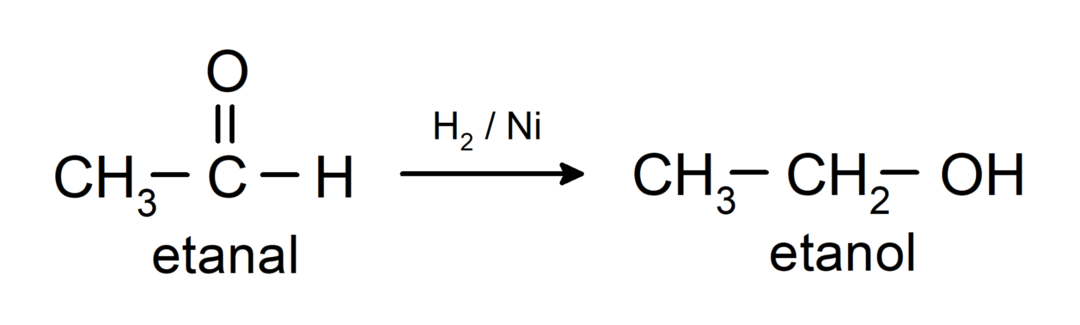
الخواص الكيميائية للكيتونات
ومن بين الخصائص الكيميائية للكيتونات يمكننا أن نجد:
أنها تخضع لتفاعلات الإضافة النووية. على سبيل المثال:
- إضافة حمض الهيدروسيانيك لتكوين سيانوهيدرين أو سيانوهيدرين.
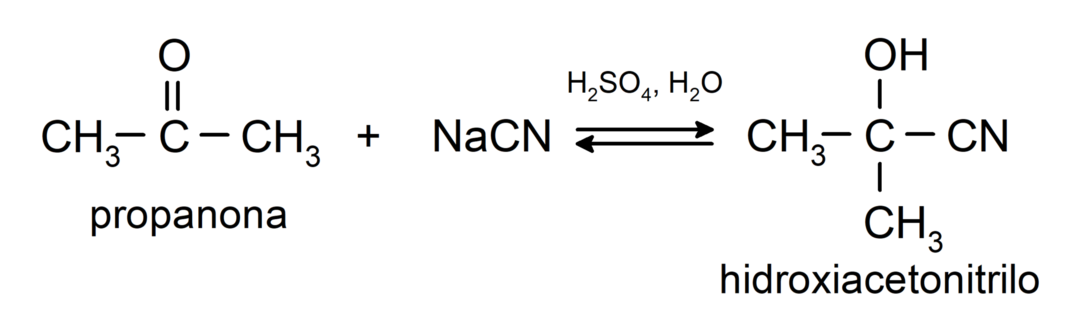
يضيفون الكحول (في وجود الأحماض اللامائية) إلى مجموعة الكربونيل من الكيتونات لتكوين الكيتالات والنصفيات. على سبيل المثال:
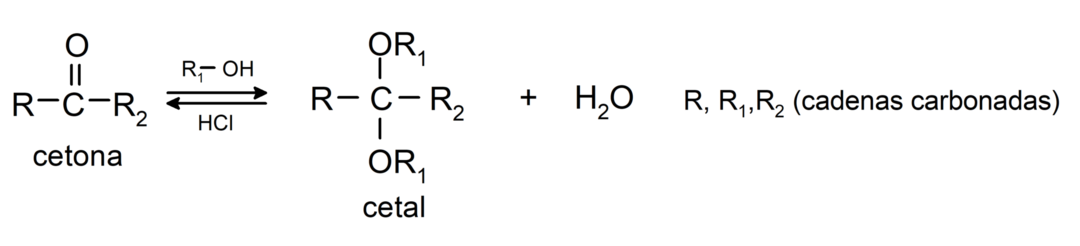
أنها تخضع لتفاعلات الهالوجين. الكيتونات التي تحتوي على ألفا هيدروجين (α) تتفاعل عن طريق استبدال هذا الهيدروجين بالهالوجينات (الكلور (Cl)، البروم (Br)، اليود (I)، الفلور (F)) في وجود محفزات حمضية أو قاعدية. يحدث الاستبدال بشكل حصري تقريبًا في الكربون αأي الكربون الذي ارتبط بالهيدروجين α. على سبيل المثال:
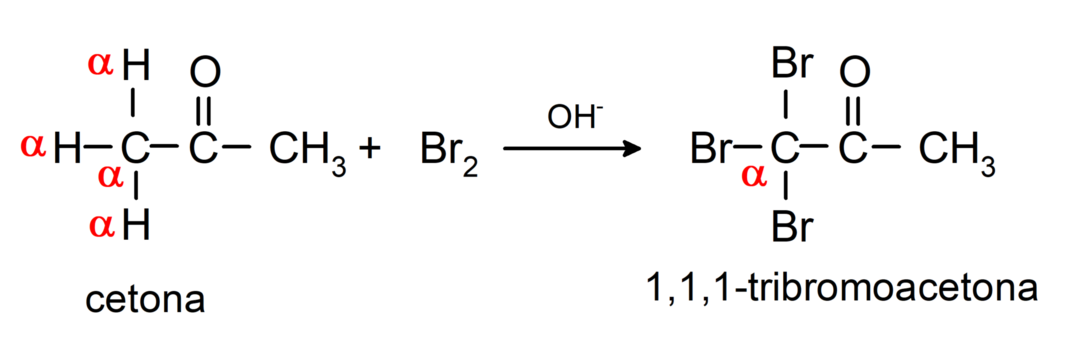
يتم تحويلها إلى كحولات ثانوية عن طريق الهدرجة الحفزية أو عن طريق الاختزال باستخدام بوروهيدريد الصوديوم (NaBH4) وهيدريد ألومنيوم الليثيوم (LiAlH4). على سبيل المثال:
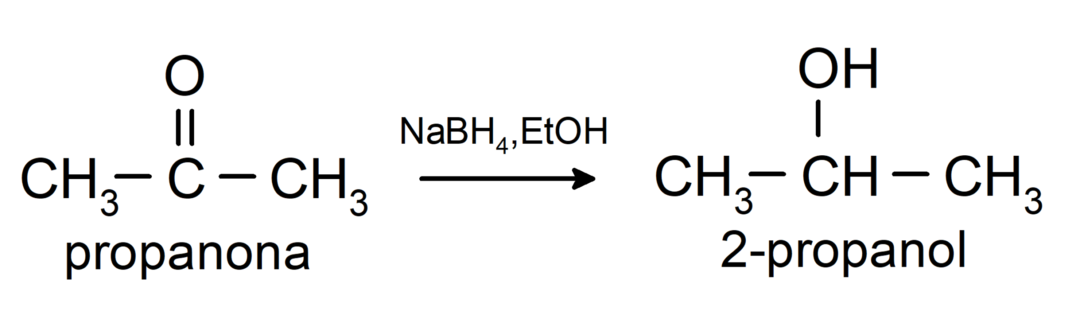
لا تتأكسد الكيتونات بواسطة كواشف تولنز وبندكت.
تسمية الألدهيدات
وفقا للقواعد التي وضعها الاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC)، تتم تسمية الألدهيدات باستخدام البادئات التي تشير إلى عدد ذرات الكربون في السلسلة. الغازية. ليس من الضروري تحديد موضع مجموعة الكربونيل، لأنها تكون دائمًا في الموضع الأول، عند أحد طرفي الجزيء. بالإضافة إلى ذلك، تتم كتابة اللاحقة -al في نهاية اسم الألدهيد. على سبيل المثال:
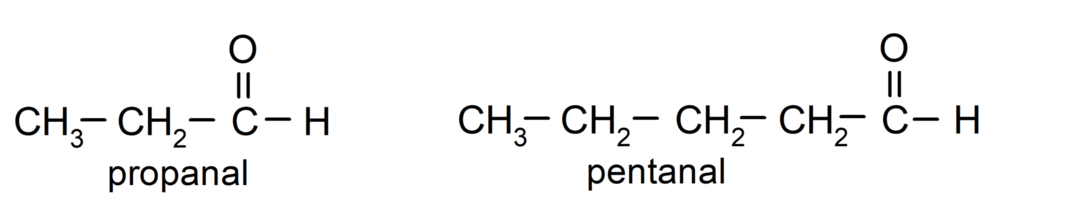
إذا كان الألدهيد مكونًا من عدة سلاسل كربون، أي أن له فروعًا، يتم اختيار سلسلة الكربون التي تحتوي على أكبر عدد من ذرات الكربون لتكون السلسلة الرئيسية. وتسمى السلاسل الأخرى كمجموعات بديلة، ويتم اختيار موضع كل بديل بحيث يشغل أقل عدد ممكن في السلسلة. وبالإضافة إلى ذلك، يبدأ عد ذرات الكربون بدءاً من النهاية التي تحتوي على مجموعة الكربونيل. على سبيل المثال:
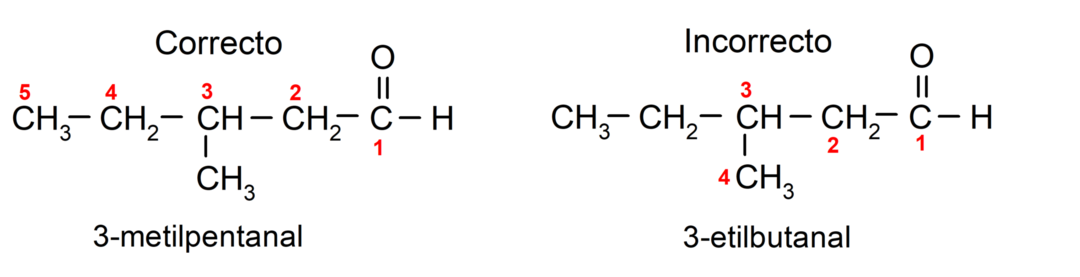
تتم تسمية الألدهيدات التي تحتوي على مجموعتين من الكربونيل باستخدام اللاحقة -dial. على سبيل المثال:
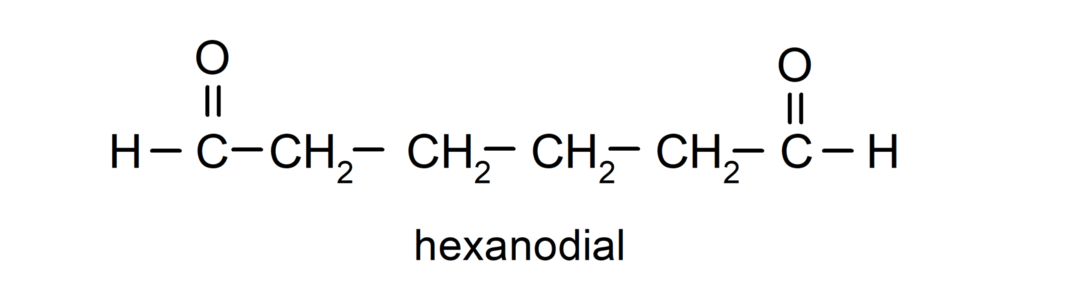
تسميات الكيتون
وفقًا للاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC)، تتم تسمية الكيتونات باستخدام البادئات التي تشير إلى عدد ذرات الكربون في سلسلة الكربون.
من ناحية أخرى، يتم كتابة اسم الأسيتون باستخدام اللاحقة -one، مسبوقة برقم يشير إلى موقع مجموعة الكربونيل في سلسلة الكربون. يجب اختيار موقع مجموعة الكربونيل بطريقة تتوافق مع أقل ترقيم ممكن. على سبيل المثال:
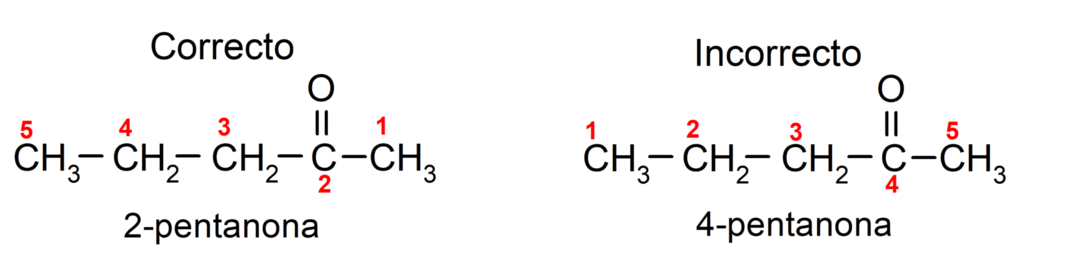
ولتسمية الكيتون الذي يتكون من عدة سلاسل كربون، أي ذات فروع، نختار باعتبارها السلسلة الرئيسية، سلسلة الكربون التي تحتوي على أكبر عدد من ذرات الكربون والتي تحتوي على المجموعة الكربونيل. تتم تسمية بقية السلاسل كمجموعات بديلة. على سبيل المثال:
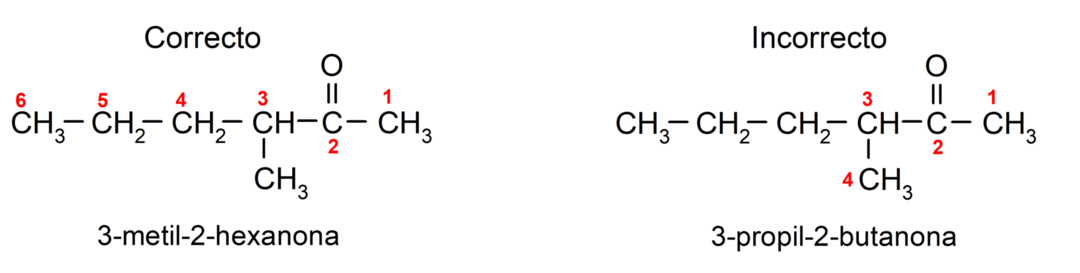
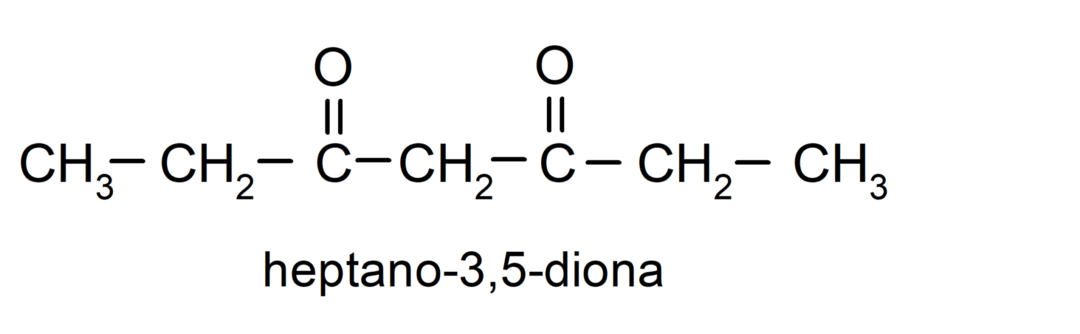
هناك الكيتونات التي تحتوي على مجموعتين من الكربونيل، تسمى ديونات. على سبيل المثال:
أمثلة على الألدهيدات
- الميثانال (الفورمالدهيد)
- إيثانال (أسيتالديهيد)
- بروبانال (بروبالديهيد)
- بوتانال
- خماسي
- سداسي
- 3-بروموسيكلوبنتين كاربالديهيد
- سيكلوهكسان كاربالديهيد
- البنزالديهايد
- 4,4-ثنائي ميثيل بنتانال
- 2-هيدروكسي بيوتانال
- 2-هيدروكسي-2-ميثيل-بيوتانال
- 2،3-ثنائي ميثيل بنتانال
- خماسي
- 4-هيدروكسي-3-ميثوكسيبنزالديهيد
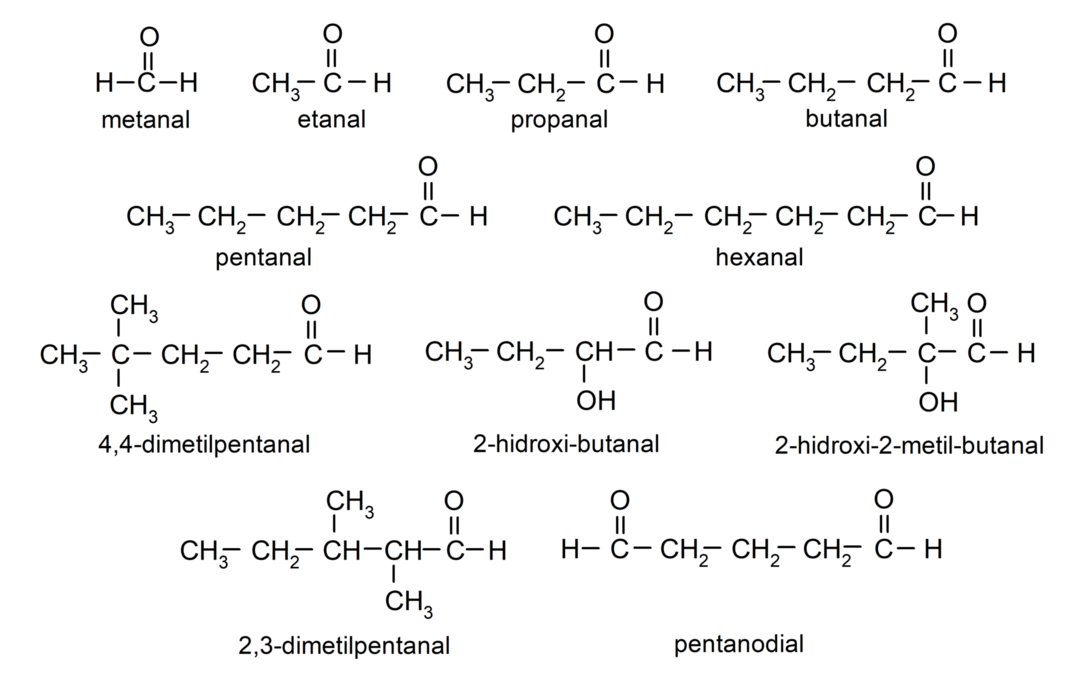
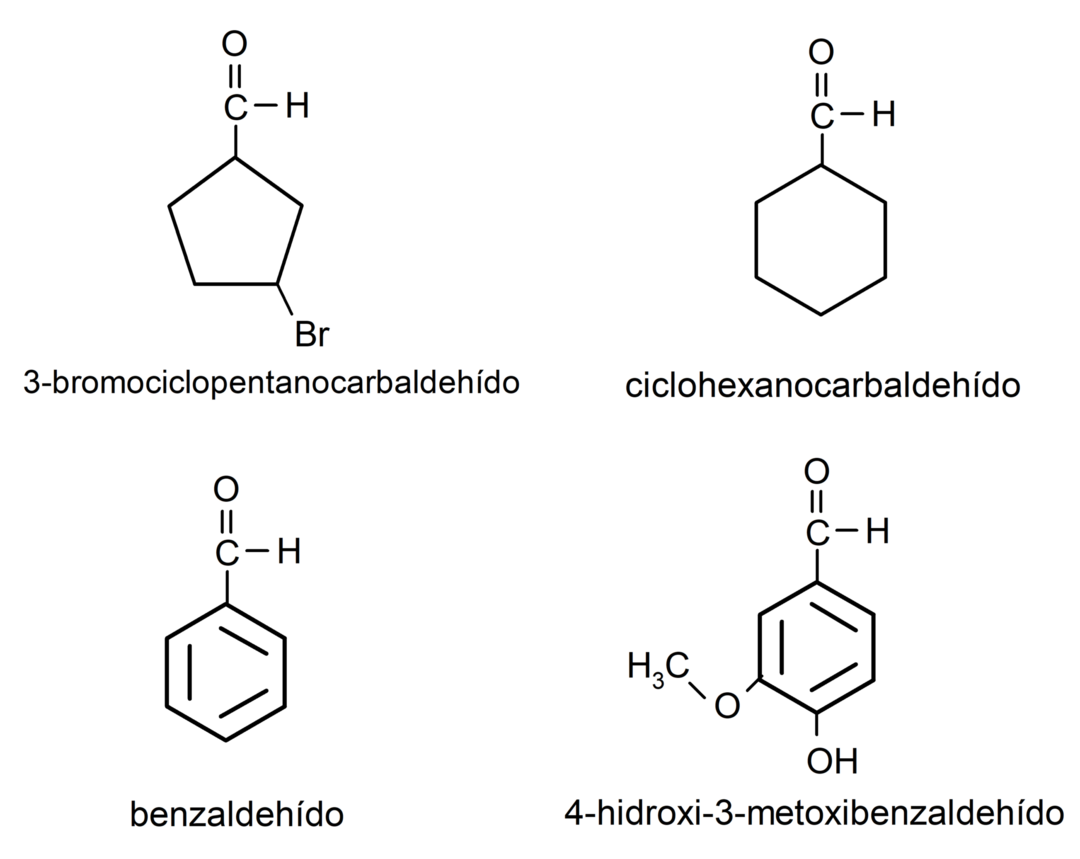
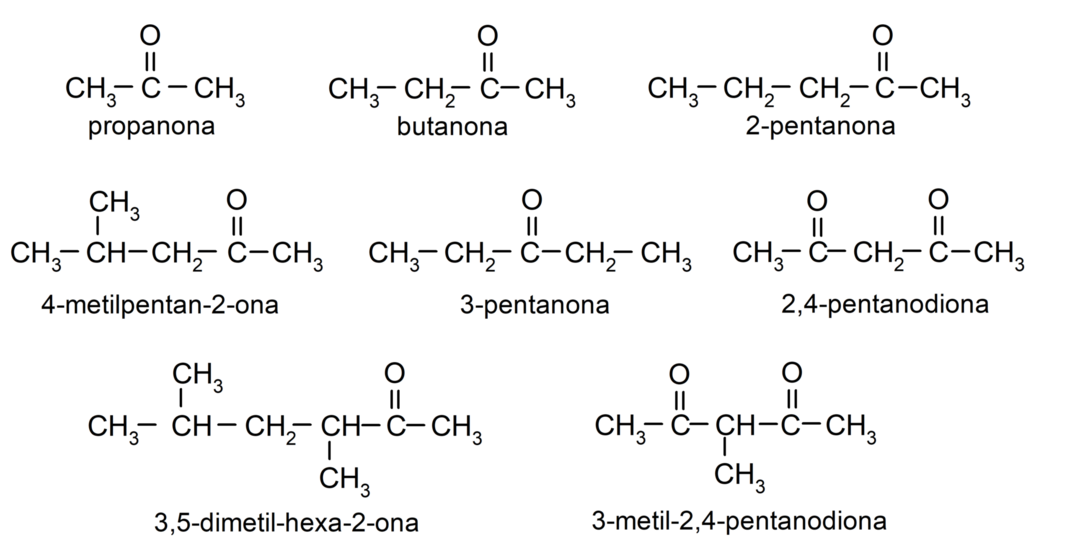
أمثلة على الكيتونات
- البروبانون (الأسيتون)
- بوتانون
- 2-بنتانون
- 4-ميثيل بنتان-2-واحد
- 3-ميثيل حلقي الهكسانون
- سيكلوهكسيل ميثيل كيتون
- 3,4 ثنائي ميثيل-هكسان-2-واحد
- إيثيل فينيل كيتون
- 2,4-بنتانيديون
- سيكلوهكسانون
- 3-بنتانون
- 3-ميثيل-2،4-بنتانيديون
- 1-فينيل بروبانون
- سيكلوبنتانون
- ثنائي فينيل كيتون
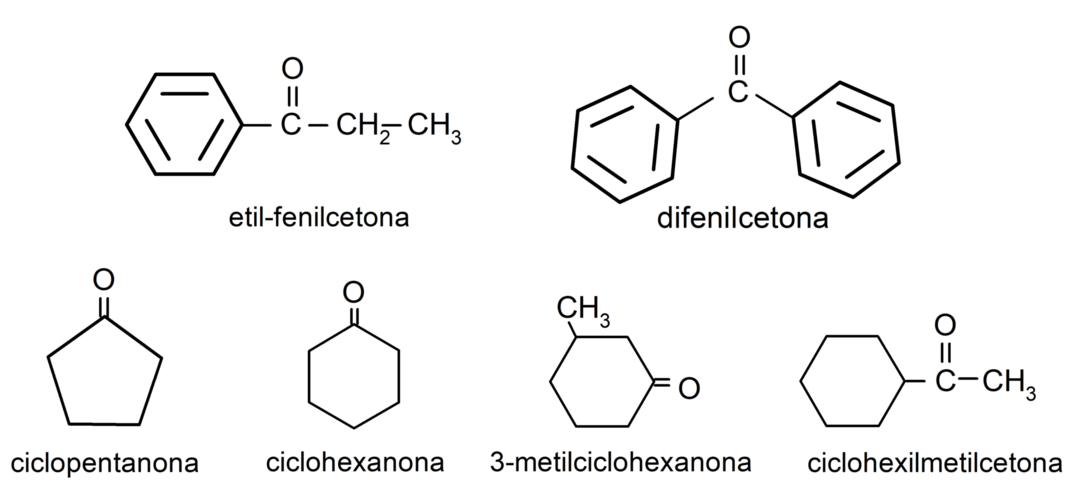
استخدامات الألدهيدات في الحياة اليومية
بعض استخدامات الألدهيدات هي:
- يتم استخدامها لإنتاج المذيبات والدهانات والعطور والراتنجات والجواهر.
- يتم استخدامها كمواد حافظة في مستحضرات التجميل والعينات البيولوجية والجثث. الفورمالديهايد هو الأكثر استخدامًا لهذه الأغراض.
- يتم استخدامها لإنتاج المواد البلاستيكية، والتي تسمح باستبدال الأجزاء المعدنية في صناعة السيارات.
- يتم استخدامها كمنكهات لبعض الأطعمة.
- يتم استخدامها كعوامل مطهرة.
- وقد تم استخدامها لصنع بعض المتفجرات، مثل رباعي نترات بنتايريثريتول (TNPE).
استخدامات الكيتونات في الحياة اليومية
بعض استخدامات الكيتونات هي:
- يتم استخدامها في إنتاج المذيبات. يستخدم الأسيتون بشكل خاص على نطاق واسع لإزالة الدهانات والورنيش.
- يتم استخدامها في صناعة بعض المطاط ومواد التشحيم.
- يتم استخدامها لإنتاج الدهانات والورنيش والورنيش.
- يتم استخدامها لإنتاج الأدوية ومستحضرات التجميل.
سمية الألدهيد والكيتون
- الألدهيدات. الاتصال مع الألدهيدات يسبب تهيج الجلد والعينين والجهاز التنفسي. بالإضافة إلى ذلك، تم ربط التعرض للألدهيدات بأمراض مثل السرطان والتهاب الجلد التماسي وأمراض الكبد والتنكس العصبي. على سبيل المثال، تعتبر منظمة الصحة العالمية (منظمة الصحة العالمية) مادة الفورمالديهايد مادة مسرطنة.
- الكيتونات. التعرض المتكرر للكيتونات يمكن أن يسبب ضررا للجهاز العصبي المركزي. وهذا يمكن أن يؤدي إلى فقدان الذاكرة، والضعف، وآلام في العضلات وتشنجات. بالإضافة إلى ذلك، إذا لامس الجلد الكيتونات، يحدث جفاف وتشققات. من ناحية أخرى، إذا تم استنشاق الكيتونات، يحدث تهيج الجهاز التنفسي والسعال.
مراجع
- لورينس مولينا، JA. (2018). “الألدهيدات والكيتونات: بعض الأمثلة.” http://hdl.handle.net/
- غابرييل بينتو كانون، مانويلا مارتن سانشيز، خوسيه ماريا هيرنانديز هيرنانديز، ماريا تيريزا مارتن سانشيز (2015) "كاشف تولنز: من تحديد الألدهيدات إلى استخدامها في تكنولوجيا النانو. الجوانب التاريخية والتطبيقات التعليمية."المجلد. 111 رقم 3. الجمعية الملكية الاسبانية للكيمياء.
- ويليام باور الابن (2000) «حمض الميثاكريليك ومشتقاته» في موسوعة أولمان للكيمياء الصناعية 2002، Wiley-VCH، Weinheim. دوى: 10.1002/14356007.a16_441.
- "إنها تكشف عن آلية جديدة للتسمم في مجموعة من المركبات المسببة للسرطان المستمدة من النظام الغذائي والبيئة" (2022) في: www.conicet.gov.ar متوفر في: https://www.conicet.gov.ar/ تم الوصول إليه: 20 يونيو 2023.
اتبع مع:
- الكحوليات
- السكريات
- الألكانات

