100 примера за химични елементи
Miscellanea / / November 13, 2021
The химични елементи са вид материя, която по никакъв начин или химическа реакция те могат да бъдат намалени или разложени на други по-прости елементи. Поради тази причина може да се каже, че елементът е всичко материя направено от атоми от същия и уникален клас, тоест атоми, които имат един и същ атомен номер (равен брой протони), въпреки че имат различна атомна маса. Например: сяра, бор, хром, калай.
Първото определение за химичен елемент е въведено от Lavoisier в Traite Élémentaire de Chimie, през 1789г. Още през 18-ти век Лавуазие подразделя простите вещества на четири групи:
Периодична таблица на елементите
Днес те се познават 118 химични елемента. Всички те са събрани, класифицирани и организирани според много от техните свойства в графична схема, известна като Периодичната система на елементите, която първоначално е създадена от руския химик Димитри Менделеев през 1869г. Периодичната система се състои от 18 групи (колони) и 7 периода (редове), в които се намират химическите елементи.
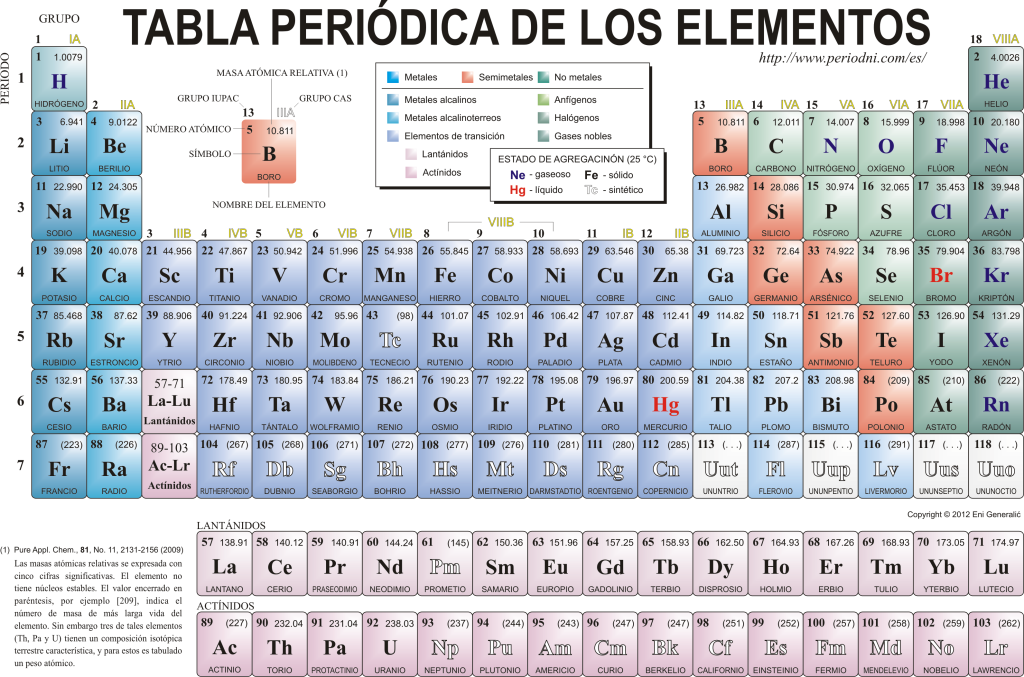
The основни групи които можете да намерите в тази таблица са:
Алкалните метали (група 1), алкалоземните метали (група 2), скандиевото семейство, което включва земите и актинидите (група 3), титановото семейство (Група 4), семейство ванадий (група 5), семейство хром (група 6), семейство манган (група 7), семейство желязо (група 8), семейство кобалт (група 9), семейство никел (група 10), семейство мед (група 11), семейство цинк (група 12), земни елементи (група 13), карбонидни елементи, в тази група е въглеродът, който представлява основата на живота на Земята (група 14), азотообразуващите елементи (група 15), амфигенетичните елементи, включва кислород, основен елемент за на дишане от живи същества (Група 16), халогенни елементи (група 17) и благородни газове (група 18).
Много от тези елементи имат стабилни или радиоактивни изотопи, тоест един и същ химичен елемент, например водород (Н), може да има няколко изотопа (1H, 2H, 3Н). Това означава, че всеки изотопен атом има еднакъв брой протони (което означава, че принадлежи към един и същ химичен елемент) и различен брой неутрони.
Някои изотопи не са стабилни (радиоактивни), т.е. разпада се за определено време, излъчвайки определени частици (неутрони, фотони, алфа частици, наред с други) и генериращи други стабилни или радиоактивни изотопи. Химичните елементи имат свойства като точката на кипене и това на синтез, електроотрицателност, плътност и йонния радиус, наред с други. Тези свойства са важни, защото ни позволяват да предскажем неговото поведение, реактивност и т.н.
Как са представени елементите в Периодичната таблица?
Всеки химичен елемент се характеризира в Периодичната таблица използвайки определена симвология. На първо място, в центъра на всеки квадрат е универсалният му символ, който се състои от един или два букви (по конвенция, ако има две букви, първата се пише с главни букви, а следващата с малки букви).
Отгоре и отляво се появява в малък шрифт su атомно число, който е този, който показва количеството протони, които този елемент има. Под символа на елемента се появява името му, а горе, вляво, се появява името му. атомна маса роднина. В допълнение, цветът, в който е представен символът на елемента, означава неговото състояние на агрегиране (според представянето, използвано във всяка Периодична таблица).
Наличните различни елементи атомни радиуси променливи и с увеличаването на броя на протоните в ядрото, толкова по-голямо е привличането, което ядрото упражнява върху електроните, така че атомният радиус има тенденция да намалява. Когато атомният радиус е малък, електроните на най-външното ниво на облака са много привлечени от ядрото, така че те не се предават лесно. Обратното се случва с елементи с високи атомни радиуси: те се отказват лесно от външните си електрони.
По този начин атомният радиус се увеличава отгоре надолу, когато преминем през групите на Периодичната система и намалява отляво надясно, докато преминаваме през техните периоди.
Примери за химични елементи
| Химичен елемент | Символ |
| Актиний | Ac |
| Алуминий | Към |
| Америций | А.М. |
| Антимон | Sb |
| Аргон | Ар |
| Арсен | Асо |
| Астат | В |
| Сяра | С |
| Барий | Ба |
| Берилий | Бъда |
| Беркелиум | Bk |
| Бисмут | Би |
| Бохрио | Bh |
| Бор | Б. |
| Бром | Br |
| Кадмий | CD |
| Калций | AC |
| Калифорний | Вж |
| Въглерод | ° С |
| Церий | ЕО |
| Цезий | Cs |
| Хлор | Cl |
| Кобалт | Ко |
| Мед | Cu |
| Chrome | Кр |
| Куриум | См |
| Дармстадио | Ds |
| Диспрозиум | Dy |
| Дубний | Db |
| Айнщайн | то е |
| Ербий | Ър |
| Скандий | Sc |
| Калай | Sn |
| Стронций | г-н |
| Европиум | ЕС |
| Фермиум | Fm |
| Флуор | F |
| Съвпада | P |
| Франций | О |
| Гадолиний | Gd |
| Галий | Ga |
| Германий | Ge |
| Хафний | Hf |
| Хасио | Hs |
| Хелий | аз имам |
| Водород | З. |
| Желязо | Вяра |
| Холмий | Хо |
| Индийски | В |
| Йод | Аз |
| Иридий | Да отида |
| Итербий | Yb |
| Итрий | Y. |
| Криптон | Кр |
| Лантан | The |
| Лоуренсио | Lr |
| Литий | Ли |
| Лутеций | Пон |
| Магнезий | Mg |
| Манган | Mn |
| Мейтнериус | Mt |
| Менделевиум | Md |
| живак | Hg |
| Молибден | Mo |
| Неодим | Na |
| Неон | Не |
| Нептуний | Np |
| Ниобий | Nb |
| Никел | Нито едното |
| Азот | н |
| Нобелио | Не |
| Злато | Au |
| Осмиум | Вие |
| Кислород | ИЛИ |
| Паладий | P.S. |
| Сребро | Ag |
| Платина | Pt |
| Водя | Pb |
| Плутоний | Пу |
| Полоний | Po |
| Калий | К |
| Празеодим | Pr |
| Обещайте | P.m |
| Протактиний | Татко |
| Радио | Ра |
| Радон | Rn |
| Рений | Re |
| Родий | Rh |
| Рубидий | Rb |
| Рутений | Ru |
| Рутерфордио | Rf |
| Самарий | Да |
| Seaborgio | Sg |
| Селен | Знам |
| Силиций | Да |
| Натрий | Na |
| Талий | Tl |
| Тантал | Ta |
| Технеций | Tc |
| Телур | Чай |
| Тербий | Tb |
| Титан | Вие |
| Торий | Th |
| Тулий | Тм |
| Коперник | Cn |
| Ливерморио | Lv |
| Рентгенио | Rg |
| Унонокций | Ууо |
| Унпентий | Uup |
| Флеровио | Ет |
| Ununseptio | Uus |
| Унтриум | Uut |
| Уран | ИЛИ |
| Ванадий | V |
| Волфрам | W |
| Ксенон | Xe |
| Цинк | Zn |
| Цирконий | Zr |

Следвайте с:
