Какво е електролиза
Химия / / July 04, 2021
В химията, Електролиза е явлението, при което електрически ток преминава през воден разтвор на йонно съединение, и започва насочете йоните (заредени частици) на съединение а два Електрода, положителен (Анод, привлича отрицателно заредени аниони) и отрицателни (Катод, привлича положително заредени катиони). Това явление се урежда от закона на електростатиката, който показва, че противоположните заряди се привличат взаимно.
Електролити
През 1883 г. Майкъл Фарадей открили, че водните разтвори на някои вещества провеждат електрически ток, докато разтворите на други вещества не.
За да провери дали водният разтвор провежда или не електрически ток, Фарадей проектира прост апарат, състоящ се от a 110 волта постоянна верига, лампа, Y два метални или графитни електрода, свързани към текущия източник.
Ако електродите са потопени във вода, количеството на протичащия ток е толкова малко, че лампата не светва; същото важи и ако са потопени в захарен разтвор.
Напротив, ако са потопени в разтвор на Натриев хлорид NaCl
или от Хлороводородна киселина HCl, лампата свети ярко, което доказва, че разтварянето е отличен проводник. От друга страна, използване на оцетна киселина СН3Концентриран COOH, разтворът провежда тока лошо, но когато киселината се разрежда с вода H2Или неговата електрическа проводимост се увеличава.По време на преминаването на тока през различни разтвори, при електродите се получават различни продукти.
В хода на изследванията си по електролиза Фарадей изведе следните закони:
1-ви закон: Количеството вещество, което има своята химическа трансформация в електрод, е пропорционално на количеството електричество, което преминава през разтвора.
2-ри закон: Ако едно и също количество електричество се предава през различни разтвори, теглото на веществата разложени или отложени върху различните електроди са пропорционални на еквивалентните тегла на споменатите вещества.
За да посочим пример:
Предполага се, че имате пет различни електролитни клетки. Първият с Солна киселина HCl, втората с Меден сулфат CuSO4, третият с Антимоничен хлорид SbCl3, четвъртата с Станов хлорид SnCl2 а петата с Станов хлорид SnCl4.
Същият ток преминава през поредица от електролитни клетки, докато не се отделят 1008 грама водород (а Еквивалентно тегло на водорода) на разтвора на солната киселина, теглото (в грамове) на другите продукти, освободени по същото време Те са:
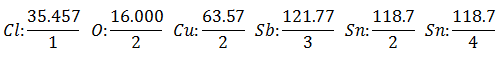
The Еквивалентно тегло има стойността на Атомно тегло на елемента, разделено на Валенсия на елемента.
За да освободите еквивалентно тегло на който и да е елемент, имате нужда 96500 кулони. Това количество електричество се нарича 1 Фарадей.
Звеното на Фарадей
Ампер се определя като равномерен поток, който отлага 0,001118 грама сребро (Ag) от разтвор на сребърен нитрат (AgNO3) за секунда. Тъй като атомното тегло на среброто е 107,88 g / mol, съотношението 107,88 / 0,001118 дава на брой ампер-секунди или кулони необходимо електричество да депозира химически еквивалент на сребро. Това количество е 96494 кулони (стойността 96500 е приблизително приблизителна за по-прости изчисления) и се нарича 1 Фарадей на електричеството.
Електроди
Обади се Фарадей Анод към положителен електрод и катод към отрицателен електрод. Той също така създава термините Анион и Катион, прилагани към веществата, които се появяват съответно на анода и на катода по време на Електролиза.
В момента друго определение за електроди е:
Анод: Електрод, при който има загуба на електрони или окисляване.
Катод: Електрод, в който има електронно усилване или редукция.
Електролити и неелектролити
Провеждането на електрически ток през разтвори не е обяснено задоволително до 1887 г., когато Сванте Арениус прави своята теория известна. Преди да оценим и разберем теорията на Арениус, първо изложихме някои от фактите, които бяха известни на науката, когато Арениус я формулира:
The Неелектролитни разтвори те имат свойства, които могат да бъдат изчислени чрез прилагане на закона на Раул. Наляганията на парите и наблюдаваните точки на кипене и замръзване на тези разтвори са практически същите като изчислените стойности.
The Законът на Раул обяснява, че налягането на парите на всяко разтворено вещество в разтвор зависи от собствената му молна част в него, умножено по неговото налягане на парите в чисто състояние.

Законът на Раул се проваля, когато се прилага за електролитни разтвори във вода. Вариациите на налягането на парите и на точките на кипене и замръзване винаги са по-големи от тези, предвидени от гореспоменатия закон, и освен това те се увеличават при разреждане.
Такива отклонения са представени от стойността i, която е съотношението на вариацията, наблюдавана в точката на замръзване, между вариацията, изчислена в точката на замръзване:

Стойността на i е мярка за отклонението от закона на Раул, равна на 1, когато няма отклонение.
Електрическа проводимост на електролитите
Арениус изследва проводимостта на водни електролитни разтвори, за да разбере как варира проводимостта с концентрацията на електролитите.
Той измерва моларната проводимост (която е проводимостта, съответстваща на един мол разтворен електролит; т.е. специфичната проводимост, посочена за един мол, и установява, че тя се увеличава с разреждане.
Арениус сравнява резултатите си с измервания на отклоненията от закона на Раул и открива тясна връзка между тях и моларната проводимост. В неговата теория се обяснява поведението на електролитите:
„Молекулите на електролитите се разделят на електрически заредени частици, наречени йони. Разтварянето е непълно и има равновесие между молекулите и техните йони. Йоните провеждат тока, докато се движат в разтвора ”.
Отклоненията от закона на Раул се дължат на увеличаването на броя на частиците в резултат на частичната дисоциация на молекулите.
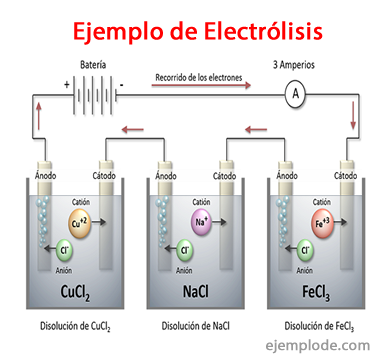
Примери за електролиза
Някои решения, които се държат като електролити, т.е. те имат способността за електролиза, са:
Натриев хлорид NaCl
Солна киселина HCl
Натриев сулфат Na2ЮЗ4
Сярна киселина Н2ЮЗ4
Натриев хидроксид NaOH
Амониев хидроксид NH4О
Натриев карбонат Na2CO3
Натриев бикарбонат NaHCO3
Азотна киселина HNO3
Сребърен нитрат AgNO3
Цинков сулфат ZnSO4

