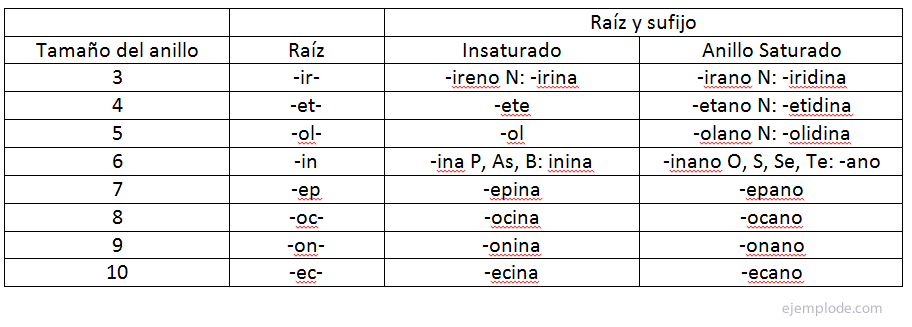
Definice periodických vlastností (atomový poloměr, iontový poloměr, PI a elektroafinita)
Různé / / December 03, 2021
Pojmové vymezení
Jsou to chemické vlastnosti založené na konfiguraci jejich valenčních elektronů a mají tendenci sdružené v určitém období periodické tabulky, pokud jsou prvky umístěny podle jejich atomového čísla (Z) rostoucí. Nejdůležitější vlastnosti ke studiu jsou: atomový poloměr, iontový poloměr, ionizační potenciál a elektroafinity.

Chemický inženýr
atomové rádio
Hodnotou atomového poloměru definujeme vzdálenost existující mezi dvěma jádry vázaných atomů. Zatímco kovy tvoří sítě navzájem rovných atomů, nekovy tvoří molekuly spojující různé prvky, proto v těchto případech záleží zásadně na síla odkazu, který je k sobě více či méně přitahuje.
Jaký je trend podle atomového čísla? Ve stejném období, jak se atomové číslo zvyšuje, zvyšujeme protony v atomovém jádře a elektrony umístěné na stejné úrovni Energie, takže stínící účinek elektronů vnitřní konfigurace se nemění. Z tohoto důvodu je účinná jaderná nálož na elektron nejvzdálenější se zvětšuje, a proto se atomový poloměr zmenšuje. Vzhledem k tomu, že zvýšením atomového čísla ve stejné skupině
Periodická tabulkaProtony v jádře se zvyšují, ale také elektrony, které se nacházejí na úrovních dále od jádra, s čímž je efektivní jaderný náboj na nejvzdálenějším elektronu vždy stejný, a tedy i atomový poloměr zvyšuje.Iontový poloměr
Iontový poloměr umožňuje studium vazebných energií zahrnutých v iontových sloučeninách, známých jako energie mřížky. Proto je důležité pochopit, jak na to analyzovat poloměr aniontu nebo kationtu.
Když neutrální prvek ztratí jeden nebo více elektronů, má ve svém jádru vysoký náboj, který elektrony přitáhne silněji. elektrony, které zachovává, takže při ztrátě valenčních elektronů je poloměr iontu menší než poloměr atomu neutrální. Opak nastane, když neutrální prvek získá elektrony a vytvoří anion. The druh záporně nabité začleněné nové elektrony zachovávající stejný náboj ve svém jádru, takže poloměr iontu je větší než poloměr neutrálního atomu předchozího.
Když jsou studovány izoelektronické druhy, jako jsou: Na+; Mg+2 a Ne, všechny tyto druhy mají ve své elektronické konfiguraci 10 elektronů; Na + má však ve svém jádru 11 protonů, zatímco Mg+2 12 protonů a Ne 10 protonů. To vysvětluje, proč je Ne větší než Na+ a tyto větší než Mg+2. Tváří v tvář stejné elektronové konfiguraci bude mít druh, který má více protonů, více nábojů, které budou přitahovat elektrony, a v důsledku toho se poloměr zmenší.
Iontové i atomové poloměry se měří v pikometrech a jsou uvedeny v tabulkách.
Ionizační potenciál
Představuje minimální energii, která musí být dodána prvku v plynném stavu (v jeho základním stavu), aby se z něj utrhl elektron.
Jaký je trend podle atomového čísla? Když zvýšíme atomové číslo v periodě, ionizační energie se zvýší, protože, jak jsme viděli, se atomový poloměr zmenšuje kvůli nárůstu jaderného náboje, takže je logické myslet že odstranění elektronu bude znamenat vzdát se více energie. Zatímco při zvýšení atomového čísla ve skupině se atomový poloměr zvětšuje, potenciál první ionizace tedy klesá.
Pokud vznik ion pozitivní výsledky ve vyšší stabilitě, bude ionizační energie nižší, např. případ kovů, kde ztrátou elektronů více přijímají elektronovou konfiguraci ušlechtilejšího plynu u. Pokud nová elektronová konfigurace dává druhu další stabilitu, ionizační potenciál je redukován, což je případ druhů, které ztrátou jednoho nebo více elektronů přijmou konfigurace s vrstvami zpola naplněné.
Hovoříme o energii první, druhé, třetí ionizační energie, protože je požadováno odstranění jednoho nebo více elektronů.
Elektroafinita
Je to vlastnost související s energií zapojenou do procesu, která dává představu o tendenci atomu tvořit anion. Opět odkazujeme na atom v plynném a základním stavu. Čím více energie proces uvolní, tím snazší bude vytvoření aniontových druhů.
Vezměme si halogeny, které při vytváření aniontu získávají určitou dodatečnou stabilitu tím, že svou elektronovou konfiguraci připomínají konfiguraci vzácného plynu. Zde se zvyšuje elektronová afinita.
Proto se elektronová afinita zvyšuje v období, kdy se atomové číslo zvyšuje, a v celé skupině, když se atomové číslo snižuje.
Témata v periodických vlastnostech (atomový poloměr, iontový poloměr, PI a elektroafinita)