Příklad chemických prvků
Chemie / / July 04, 2021
Chemický prvek je to čistá látka složená z atomů stejného typu, podle pořadí tvořil množstvím protonů a neutronů v jádřea množství elektrony na jejich orbitálech. Některé se nacházejí přirozeně, jiné vytvářením molekul sloučeniny a jiné byly vytvořeny provedením laboratorních postupů. Všechny chemické prvky tvoří hmotu celého vesmíru a udržují existenci a fungování lidského těla.
Každý prvek má vlastnosti a chování, které ho odlišují a činí jedinečným, ale zároveň představuje podobnosti se skupinou prvků v projevu, který mají v vesmír. Z tohoto důvodu existuje Periodická tabulka chemických prvků, která řeší tyto podobnosti, aby koherentně seskupila prvky a usnadnila studium jejich vlastností.
Atomové číslo prvku
Atom nese v jádře řadu protonů, doprovázených stejným počtem neutronů. K tomuto číslu nazývá se to atomové číslo, zastoupená jako Z pro akademické účely a v literatuře. Pro každý prvek bude toto číslo jedinečné. Neexistují žádné dva prvky se stejným atomovým číslem. Periodická tabulka se také zaměřuje na toto kritérium pro jejich objednání.
Symbol prvku
V dobách alchymie, která trvala přibližně rok 400 až 1000 našeho letopočtu. C., alchymisté zaznamenali své experimenty s přiřazením symbolů k prvkům. Byly to jednoduché symboly vytvořené z geometrických obrazců, které představovaly jednotlivý prvek a studované transformace.
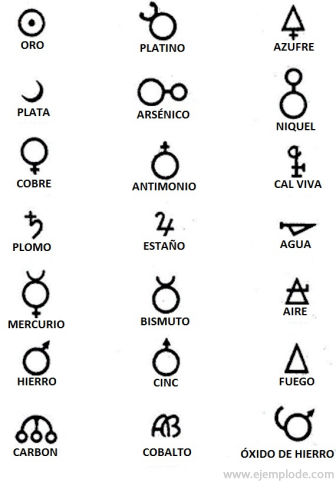
Několik příkladů alchymistických symbolů s názvem prvku nebo sloučeniny, kterou představovali.
V éře moderní chemie jsou prvky stále zastoupeny symboly, v tomto případě písmeny, která odkazují na jejich jméno v latině nebo angličtině.
Například:
Symbol pro sodík je Na, latinským názvem Natrium
Symbol zlata je Au, latinským názvem Aurum
Symbol pro stříbro je Ag, latinským názvem Argentum
Symbol pro měď je Cu, latinským názvem Měď
Symbol Antimon je Sb, latinským názvem Stibium
Symbol železa je Víra, latinským názvem Ferrum
Symbol Merkuru je Hg, latinským názvem Rtuť, což znamená „tekuté stříbro“
Symbol pro draslík je K., latinským názvem Kalium
Skupiny chemických prvků:
Periodická tabulka chemických prvků je klasifikuje podle skupin: skupiny A a skupiny B. Skupiny A jsou osm, které obsahují prvky Alkalické„ Alkalické-zemité„ Terreos, tři rodiny prvků, jejichž hlava definuje jméno rodiny: Uhlíková rodina, Rodina dusíku, Síra rodina„ Halogeny a vzácné plyny. Skupiny B se skládají ze všech Přechodné kovy a Vzácné Země, což jsou také dvě velké Rodiny: Lanthanidy Y Aktinidy.
Skupina IA: Alkalické prvky:
Řadu alkalických prvků tvoří vodík (H), lithium (Li), sodík (Na), draslík (K), rubidium (Rb), cesium (Cs) a francium (Fr). Všechny mají elektronickou konfiguraci, takže v poslední skořápce mají elektron. Jejich název je způsoben skutečností, že při kontaktu s vodou reagují za vzniku zásad nebo hydroxidů. Jedná se o obecné chování mezi těmito prvky. Čím větší je atom prvku, tím je reaktivnější, protože síla, s níž jádro zadržuje elektron z posledního pláště, má stále menší dosah. Jsou schopné tvořit iontové vazby s halogeny. Například: Iontová vazba, která má hojnou přítomnost, je vazba sodíku a chloru, která tvoří chlorid sodný NaCl.
Skupina IIA: Prvky alkalických zemin:
Jedná se o tyto prvky: berylium (Be), hořčík (Mg), vápník (Ca), stroncium (Sr), baryum (Ba) a radium (Ra). Nejsou volné povahy; na druhé straně jeho uhličitany a křemičitany existují v relativním množství. Jsou argentinské bílé a krystalické. Pokud jsou vystaveny vzduchu, snadno se kombinují s kyslíkem. To je částečně způsobeno skutečností, že mají ve své poslední skořápce dva elektrony, což odpovídá kapacitě přijímat kyslík. Baryum je nejaktivnějším prvkem skupiny a společně s vápníkem jsou těmi, které mají ve skupině nejprůmyslovější aplikace.
Skupina IIIA: Zemské prvky:
Skupina IIIA zahrnuje prvky bor (B), hliník (Al), galium (Ga), indium (in) a thallium (Tl). Bor je nekovový prvek, hliník je amfoterní (amfiprotický), to znamená, že je schopen působit jako kyselina a jako báze; a další tři jsou kovové prvky. Ve svém posledním plášti mají tři elektrony, které generují valenci +3, i když někdy Gallium v některých svých sloučeninách působí s valencí +1 a +2. Bor je jediným prvkem v této sérii, který tvoří hydridy. Bór a hliník tvoří karbidy.
Skupina IVA: Rodina uhlíků:
Reprezentativní prvky skupiny IVA jsou uhlík (C), křemík (Si), germánium (Ge), cín (Sn) a olovo (Pb). První dva jsou ve své podstatě zásadně nekovové, ale germánium, cín a olovo jsou kovové a čím více, tím vyšší je jejich atomové číslo. S výjimkou křemíku má každý prvek valence +4 a +2.
Uhlík a křemík tvoří sloučeniny, ve kterých jsou atomy prvků spojeny dvojicemi sdílených elektronů. Uhlík je podstatou organických sloučenin spojením s atomy vodíku, kyslíku, dusíku, síry a někdy křemíku.
Křemík a germánium se používají k výrobě elektronických součástek, protože se chovají jako polovodiče.
Skupina VA: Rodina dusíku:
Skupina VA zahrnuje prvky dusík (N), fosfor (P), arsen (As), antimon (Sb) a vizmut (Bi). Dusík a fosfor jsou nekovové, arsen a antimon jsou metaloidy a vizmut je kov. Tyto prvky se vyznačují tvorbou hydridů, z nichž nejméně toxický je amoniak NH3. Dusík tvoří kyselinu dusičnou HNO3, podílející se společně s kyselinou chlorovodíkovou v Agua Regia, směsi schopné rozpouštět drahé kovy, jako je zlato a stříbro.
Dusík je také zapojen do dvou velkých skupin organických sloučenin zvaných aminy a amidy, které lze považovat za deriváty amoniaku NH3, substitucí vodíku za uhlovodíkový řetězec.
Skupina VIA: Rodina kyslíku:
Skládá se z prvků Kyslík (O), Síra (S), Selen (Se), Tellurium (Te) a Polonium (Po). Kyslík je nejaktivnější a má schopnost snadno vytvářet kovalentní vazby. Při kontaktu s kovy v prostředí s vysokou vlhkostí vytváří oxidy. Vytváří rezonanční molekulu zvanou Ozon, která chrání planetu před UV zářením.
Skupina VIIA: Halogeny:
Jeho název znamená „Tvůrci prodeje“. Skupinu tvoří prvky Fluor (F), Chlor (Cl), Brom (Br), Jod (I) a Astate (At). V poslední skořápce mají sedm elektronů, což jim umožňuje být receptory pro jeden elektron. Tato kvalita je spojuje s prvky skupiny IA a vytváří binární soli. Fluor se vyznačuje tím, že má největší elektronegativitu z celé periodické tabulky s hodnotou 4,0, protějškem je cesium, s elektronegativitou 0,7. Tato vlastnost mu umožňuje mít sílu přilákat další atomy a dát přednost vytvoření vazby ony.
Skupina VIIIA: Ušlechtilé plyny:
Také se nazývá skupina inertních plynů a skládá se z prvků Helium (He), Neon (Ne), Argon (Ar), Krypton (Kr), Xenon (Xe) a Radon (Ra). Jsou to prvky, které mají veškerou svou úplnou elektronickou konfiguraci, takže nejsou schopné reagovat za obvyklých podmínek. Používají se hlavně pro světelné obchodní značky, emitující viditelné světlo, když na ně dopadá elektrický proud.
Skupiny B: Přechodné kovy:
V deseti skupinách po třech prvcích jsou přechodové kovy seskupeny. Patří mezi ně nejlepší elektrické vodiče: stříbro (Ag), měď (Cu), zlato (Au); nejlepší konstrukční prvky pro městskou výstavbu a strojírenství; Železo (Fe), titan (Ti), hliník (Al), zirkonium (Zr), wolfram (W); nejlepší komponenty katalyzátoru: nikl (Ni), vanad (V), platina (Pt); a hlavní složky nátěru: kadmium (Cd), chrom (Cr), zinek (Zn). Obvykle zpracovávají valence mezi +1 a +3, ale prvky jako Chromium zpracovávají valence +2, +3, +6.
Vzácné zeminy: Lanthanidy a aktinidy:
Nazývají se Vzácné Země kvůli jejich nedostatku na planetě. Skládají se ze dvou skupin: Lanthanidy a Actinidy. Nacházejí se na dvou samostatných řádcích Periodické tabulky. Pracují obecně s valencí +3 a mají tendenci tvořit hydroxidy. Nejdůležitějším prvkem mezi nimi je cer, který se používá při přípravě pyroforických slitin (Alloy Mischmetal, pro kameny do zapalovačů), v plynových hadicích pro osvětlení a při výrobě speciálních brýlí absorbujících ultrafialové paprsky a tepelné záření.
Nejvýkonnější radioaktivní prvky, jako je uran (U) a plutonium (Pu), jsou součástí těchto skupin. které vzhledem k jejich nestabilitě uvolňují energii a rozpadají se a ztrácejí alfa částice (jádra z Hélium). Později se stanou méně nestabilními prvky, podle radioaktivní série.

