Beispiel für organische Chemie
Chemie / / July 04, 2021
Das Organische Chemie Es ist der Teil der Allgemeinen Chemie, der für das Studium und die funktionelle Klassifikation chemischer Verbindungen zuständig ist, deren Strukturelement die Kohlenstoff, in Hülle und Fülle vorhanden lebende Materie; So entsteht ein gut differenziertes Universum der Anorganischen Chemie, das sich den als Minerale klassifizierten chemischen Verbindungen widmet.
Das Kohlenstoffatom hat in der letzten Schale seiner elektronischen Konfiguration vier Elektronen. Diese Eigenschaft, zusammen mit der seines Atomradius, ermöglicht es, durch kovalente Bindungen an andere Atome desselben Elements in zahlreichen Ketten, die eine große Vielfalt chemischer Verbindungen bilden stabil.
Du kannst nachschauen Kovalente Bindungen.
Solche chemischen Verbindungen enthalten neben den Kohlenstoffatomen, die ihnen ihre ursprüngliche Struktur verleihen, Wasserstoffatome als Hauptkomplement für die Kohlenstoffvalenz. Darüber hinaus gibt es in dieser Vielfalt von Verbindungen solche mit dem Eingriff von Sauerstoffatomen, Stickstoff, Halogene, Schwefel und sogar Phosphor, Alkali- und Erdalkalielemente und Metalle von Überleitung. Je nachdem, wer an dem Molekül beteiligt ist, sind es die physikalischen und chemischen Eigenschaften der Endsubstanz.
Das organische Verbindungen sind während der gesamten lebende Materie; alle fördern und erhalten biologische Funktionen, im Gegensatz zu anorganischen oder mineralischen Stoffen, die vom Menschen zu kommerziellen Zwecken, zu Experimenten oder zur Erfüllung bestimmter Haushaltsaufgaben verwendet wurden.
Geschichte der organischen Chemie
Bereits vor 1828 wurde zwischen Organischer Chemie und Anorganischer Chemie unterschieden. Organisches Material wurde durch a. mit einer Schöpfung in Verbindung gebracht "Lebenskraft", und das Anorganische mit dem Nichtlebenden, mit dem Mineralischen. Angesichts dieser Vorstellungen konnte man nicht erwarten, organische Verbindungen aus anorganischen Materialien im Labor zu gewinnen.
Jedoch, 1828 Friedrich Wöhler (1800-1882) gelang die Herstellung einer organischen Substanz, Harnstoff CO (NH2)2, ein wichtiges Produkt des tierischen Stoffwechsels, aus anorganischen Verbindungen. Behandlung Bleicyanat Pb (CNO)2 mit Ammoniak NH3 zu bekommen Ammoniumcyanat NH4CNO; Diese Verbindung wurde tatsächlich gebildet, aber als die Lösung gekocht wurde, um das Ammoniumcyanat zu kristallisieren, wurde sie in Harnstoff umgewandelt.
Diese chemische Veränderung ist ein Beispiel für Interne Umgruppierung, bei dem sich die Anzahl oder Klasse der Atome im Molekül nicht ändert, sondern nur ihre Ordnung darin. Diese Arten von Umwandlungen sind in der organischen Chemie sehr verbreitet.
Wöhlers Entdeckung leitete später die Aufgabe der Lebenskrafttheorie ein vollständig verworfen, gefolgt von der Herstellung vieler anderer organischer Verbindungen in der Labor. Trotzdem bleiben die Qualifikationen von Anorganisch und Organisch bestehen, da anorganische Verbindungen mit mineralischen Produkten verwandt sind und organische Verbindungen, die eigentlich Verbindungen von Kohlenstoff und Wasserstoff und deren Derivate sind, werden von lebenden Organismen produziert.
Obwohl die Gesetze der allgemeinen Chemie für beide Verbindungen gleichermaßen gelten, rechtfertigen und machen verschiedene Ursachen diese Einteilung notwendig. So unterscheiden sich organische und anorganische Verbindungen in unterschiedlichen Eigenschaften, wie zum Beispiel: ihre Löslichkeit bevorzugt in organischen Lösungsmitteln (Ether, Alkohol, Chloroform etc.) bzw. in Wasser, seine Stabilität (organische Verbindungen zersetzen sich bei relativ niedrigen Temperaturen) und die Art der Reaktionen; für anorganische Verbindungen sind sie ionisch, einfach und praktisch augenblicklich, und für organische Verbindungen sind sie kovalent, komplex und langsam.
Organische Verbindungen
Kohlenstoffverbindungen mit Ketten von bis zu neunzig Atomen sind bekannt. Das Ketten Kohlenstoffatome können sein linear und verzweigt und haben einfache kovalente Bindungen oder haben Doppel- oder Dreifachbindungen. Von mehr als 2.500 Verbindungen ist bekannt, dass sie nur Kohlenstoff und Wasserstoff enthalten (Kohlenwasserstoffe).
Isomerie organischer Verbindungen
In anorganischen Verbindungen steht eine Formel im Allgemeinen für eine einzelne Verbindung; somit gibt es nur eine Substanz der Formel H2SW4. Das Schwefelsäure-Molekül enthält zwei Wasserstoffatome, eines von Schwefel und vier von Sauerstoff, in einer spezifischen und einzigartigen Anordnung. In organischen Verbindungen ist es das passiert selten. So gibt es beispielsweise zwei Verbindungen, die auf die Formel C2H6Oder Ethylalkohol oder Ethanol und Dimethylether.

Je komplexer das Molekül, d. h. je größer die Zahl der Kohlenstoffatome ist, desto größer ist die Zahl der möglichen Isomere.
Analyse organischer Verbindungen
Die Analyse einer organischen Verbindung umfasst die qualitative Analyse, das quantitative Analyse und der Funktionsanalyse. Wenn angenommen wird, dass sich die Verbindung in einem unreinen Zustand befindet, wird sie zuvor gereinigt durch Kristallisation, Destillation, Sublimation, Extraktion, usw. Das Reinheitskriterium kann anhand seiner physikalischen Konstanten wie Schmelzpunkt, Siedepunkt, Dichte, Löslichkeit, Kristallform, Brechungsindex usw. beurteilt werden.
Das qualitative Analyse Es wird überprüft, indem das Vorhandensein der Elemente untersucht wird, aus denen die Verbindung besteht, insbesondere Kohlenstoff, Wasserstoff und Stickstoff und manchmal Halogene, Schwefel und Phosphor.
Das quantitative Analyse Sie wird auf Basis der Methoden der qualitativen Analyse durchgeführt. Ausgangspunkt ist eine bestimmte Stoffmenge, die verbrannt wird, und das Kohlendioxid wird gesammelt und gewogen. Kohlenstoff und Wasserdampf gebildet, um den Prozentsatz von Kohlenstoff und Wasserstoff im Verbindung. Die Ergebnisse der quantitativen Analyse erleichtern die Berechnung der empirische Formel, obwohl die Summenformel erst nach der Bestimmung des Molekulargewichts des Stoffes gefunden werden kann. Aber das Problem ist noch nicht gelöst, denn dieselbe Summenformel kann verschiedenen Isomeren entsprechen.
Klassifizierung organischer Verbindungen
Organische Verbindungen werden nach ihrer Struktur in Verbindungen unterteilt aliphatisch, aromatisch Ja heterozyklisch. Aliphatische Verbindungen sind mit Methan CH. verwandt4, sind mit Ausnahme von Cycloparaffinen offenkettig und verdanken ihren Namen der Zugehörigkeit zu dieser Gruppe von tierischen und pflanzlichen Fetten.
Das aromatische Verbindungen, geschlossene Kette, eng verwandt mit Benzol, C6H6, und sie verdanken ihren Namen der Tatsache, dass viele von ihnen duftende, angenehme Gerüche haben.
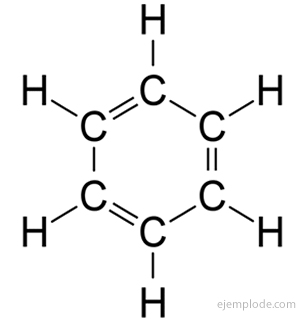
Benzolring
Das heterocyclische Verbindungen Es handelt sich um geschlossenkettige Verbindungen, bei denen ein anderes Element als Kohlenstoff im Ring vorhanden ist.
Nach ihrer Verfassung sind sie:
Kohlenwasserstoffe, das wiederum aufgrund der Art der Links klassifiziert wird als Alkane, Alkene Ja Alkine. Darüber hinaus fallen in diese Kategorie Cycloalkane, Benzol und deren Derivate, die nur aus Kohlenstoff und Wasserstoff bestehen.
Heterocyclische Verbindungen
Halogenierte Derivate:R-X
Nitroverbindungen:R-NO2
Sulfonsäuren:R-SO3H
Nitrile (OR-Alkylcyanide) und Isonitrile:R-CN und R-NC. Sie unterscheiden sich darin, wie das Stickstoffatom im Molekül gebunden ist.
Alkohole:R-OH
Phenole: Verbindungen basierend auf einem Rückgrat bestehend aus einem Benzolring mit einer hinzugefügten Hydroxylgruppe.

Äther:R-O-R
Mercaptane: R-SH
Thioether:R-S-R
Thiosäuren:R-COSH
Aldehyde:R-CHO
Ketone:R-CO-R
Carbonsäuren:R-COOH
Du gehst raus:R-COOM (M für Metall)
Ester: R-COO-R
Anhydride: R-CO-O-OC-R
Amine:R-NH2, R-NH-R, 2R-N-R
Kohlenhydrate vom Aldosa-Typ:-CHOH-CHOH-CHO
Kohlenhydrate vom Ketose-Typ:-CHOH-CO-CH2Oh
Organometallische Verbindungen:R-M-R
Metall-Alkylhalogenide:R-MX (auch bekannt als Grignard-Reagenzien)
