Verwendung von Salzsäure
Chemie / / July 04, 2021
Salzsäure Es ist der Handelsname, der Salzsäure zugewiesen wird, wenn sie in wässriger Lösung vorliegt. Salzsäure ist die anorganische chemische Verbindung, die aus einem Wasserstoffatom und einem Chloratom besteht. Es wird auch Chlorwasserstoff genannt und ist eine der wichtigsten Hydrosäuren mit einer starken Säureaktivität.
Erhalt von Salzsäure
Chlorwasserstoff wird durch Behandlung von Natriumchlorid NaCl mit Schwefelsäure H. gewonnen2SW4 konzentriert in großen gusseisernen Retorten. Die Reaktion verläuft in zwei Stufen; die erste entwickelt sich bei einer relativ niedrigen Temperatur und produziert Chlorwasserstoff HCl und Natriumbisulfat NaHSO4. Sobald die erste Phase abgeschlossen ist, wird die NaHSO-Mischung4 und überschüssiges NaCl wird in eine andere Retorte gebracht, wo es auf Rot erhitzt wird, wodurch die zweite Reaktion erzeugt wird:
NaCl + NaHSO4 -> Na2SW4 + HCl
Natriumchlorid + Natriumbisulfat (Heizung) -> Natriumsulfat + Chlorwasserstoff
Das HCl-Gas wird in Wasser freigesetzt, um handelsübliche Salzsäure herzustellen, mit einer Dichte von 1.196 g/ml und 38,9 % der Verbindung.
Für Haushaltszwecke wird es in wässriger Lösung mit einer Konzentration von 12,5% Salzsäure vermarktet. Das ist richtig Salzsäure.
Eigenschaften und Eigenschaften von Salzsäure
Das Chlorwasserstoff Es ist ein farbloses Gas mit einem starken und reizenden Geruch und einem sauren Geschmack. Es kann bei 10 ° C verflüssigt werden, wobei es einem Druck von 40 Atmosphären ausgesetzt wird. Die Flüssigkeit siedet bei -84 ° C bei Normaldruck.
Das Gas ist sehr stabil. Bei 1500°C werden weniger als 0,3% in seine Elemente zerlegt. Im gasförmigen Zustand raucht es in feuchter Luft und bildet einen Nebel aus Salzsäuretröpfchen. Mit Wasser bildet es mit 20,2% HCl ein azeotropes oder konstantes Siedepunktgemisch, das bei 110°C unter einer Atmosphäre Druck siedet.
HCl Wasserfreie Flüssigkeit leitet keinen elektrischen Strom. Es reagiert nicht mit Zink, aber es reicht aus, eine kleine Menge Wasser hinzuzufügen, um die Reaktion zu starten, wobei Wasserstoff freigesetzt wird. Wenn Chlorwasserstoff mit den aktivsten Metallen erhitzt wird, kommt es zu einer Reaktion, bei der die Chloride der Metalle und Wasserstoff erzeugt werden. Dieses Verfahren zur Herstellung von Chloriden wird verwendet, wenn keine wasserfreie Lösung aus einer wässrigen Lösung erhalten werden kann.
Anwendungen von Salzsäure
Nach Schwefelsäure wird Salzsäure in der Industrie am häufigsten verwendet. Es wird als Katalysator zur Gewinnung von Glucose und anderen Produkten durch Hydrolyse von Stärke verwendet; in der Textil-, Farbstoff- und Arzneimittelindustrie; zur Herstellung von Chloriden verschiedener Metalle und Beizbädern zur Entfernung von Oxidschlacke von Eisenblechen vor dem Verzinnen, Verzinken oder Emaillieren. Klebstoffhersteller verwenden es, um das Produkt aus tierischen Geweben (Häuten, Hufen und Knorpel) zu extrahieren.
Beispiele für die Verwendung von Salzsäure
1.- So erhalten Sie Glukose: Salzsäure wirkt als Katalysator zur Gewinnung von Glukose, da ihre Fähigkeit, in einem wässrigen Medium zu dissoziieren, es ihr ermöglicht, Stärke anzugreifen, um sie leichter zu hydrolysieren.
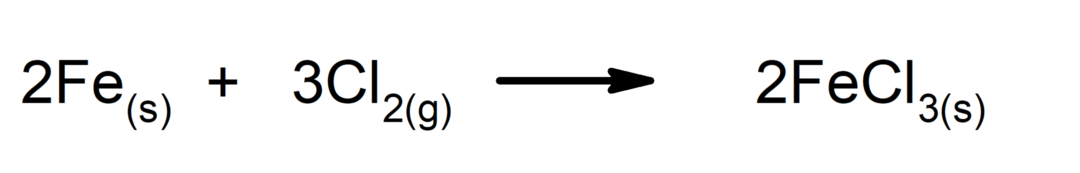
2.- Vorbereiten Chloride aus verschiedenen Metallen: Salze wie Silberchlorid (AgCl), Eisenchlorid (FeCl .)2), Natriumchlorid (NaCl), Zinkchlorid (ZnCl2) werden durch die Einwirkung des in Muriatic Acid getauchten Metalls, das eine wässrige Lösung ist, hergestellt.
3.- Zur Desinfektion von Toiletten: Die Hygiene im Badezimmer wird durch die kurzzeitige Einwirkung von Muriatic Acid, die für die Ansäuerung des Mediums, gemischt mit Seife, verantwortlich ist und die Bakterienpopulation erheblich reduziert, gewährleistet.

4.- Beizbäder für Eisenbleche: Salzsäure hilft, die Oxidschlackeschicht zu beseitigen, die sich auf Eisenplatten bildet, um lassen Sie sie wie neu, bevor Sie eine Metallschicht in einem Galvanisierungsprozess wieder aufbringen, z Beispiel.
5.- Als Zutat in Agua Regia: Agua Regia ist eine Mischung aus Salzsäure HCl und Salpetersäure HNO3. Zwischen beiden Säuren wird eine Angriffswirkung der stabilsten Metalle, wie zB Gold, erzielt. Dank Agua Regia ist es möglich, Gold aufzulösen.

6.- Um verschüttetes Öl zu neutralisieren Starke Basen: Wenn in einer Industrieanlage versehentlich eine starke Base wie Natriumhydroxid verschüttet wird, kann diese Substanz durch Zugabe von Salzsäure neutralisiert werden. Nach der Reaktion von Säure gegen Hydroxid ist bereits ein neutraler pH-Wert vorhanden und die Gefahrensituation ist beendet.
7.- So bereiten Sie Standardlösungen vor: Salzsäure in verschiedenen Konzentrationen ist nützlich, um Standardlösungen (Lösungen bekannter Konzentration) herzustellen volumetrische Analyse, bei dem die Menge einer bekannten Substanz in einer flüssigen Probe bestimmt wird.
8.- So reinigen Sie Laborglas: Salzsäure ist nützlich bei der Reinigung von Laborgeräten aus Glas. Diese Waschungen sorgen für die Auflösung und vollständige Entfernung der im Material zurückgebliebenen oder steckengebliebenen chemischen Substanzen. Manchmal wird Salzsäure erhitzt, um den Zweck besser zu erfüllen.

9.- Als chemisches Reagenz: Salzsäure kann auf Laborebene verwendet werden, um bestimmte chemische Reaktionen, ob organisch oder anorganisch, zu erzeugen. Die leichte Ablösung von Chlorid von Wasserstoff hilft, die Wechselwirkung zwischen den Reaktanten zu beschleunigen.
10.- Als Versorgung in Thermoelektrischen Anlagen: Salzsäure wird verwendet, um sie den Schalen zuzuführen, in denen das Kondenswasser gekühlt wird (in den Kühltürmen). Der Säuregehalt hilft, die Bildung von Härteablagerungen zu verhindern (Calciumcarbonat CaCO3). Diese letzte Verbindung bleibt dank dieser Zufuhr gelöst.