Keemiliste nähtuste näide
Keemia / / July 04, 2021
Keemia uurib aine koostisosi, nende moodustatavaid ühendeid ja nende võimalikke kombinatsioone nendest kombinatsioonidest tulenevad tooted ja nende struktuur ning neid tekitavad, kiirendavad või pidurdavad nähtused muudatused. A Keemiline nähtus on selline, kus kahel või enamal ainel toimub muutus, mis muudab nende sisemist struktuuri, põhjustades ühe, kahe või enama aine, mis erineb algmaterjalist.
Erinevalt füüsikalistest nähtustest, kus objektide mõned omadused on muutunud, kuid need on alati sama aine või ühend, füüsikaliste nähtuste korral muutub ainete struktuur, jättes selle tagajärjel muud ained kui need originaalid. See tähendab, et kõik keemilised nähtused on keemilised reaktsioonid, mille tulemuseks on üks või mitu ainet, mis molekulaarselt erinevad algsest ainest või ainetest.
Keemiliste nähtuste tüübid:
Keemilisi nähtusi saab tulemuse alusel klassifitseerida järgmiselt:
Süntees
Kaks või enam ühendit ühendavad omavahel keerukama ühendi.
Lagunemine
Kompleksühend laguneb, moodustades lihtsamaid molekule.
Nihutamine
Reageerivate molekulide üks elementidest või radikaal muutub osaks teisest molekulist, millega see reageerib.
Topelt kerimine
Reaktsioonis olevad molekulid vahetavad ühte elementi või radikaali, andes tulemuseks kaks erinevat molekuli, millele nad reageerisid.
Pidades reaktsioone keemiliste nähtustena, võime mainida järgmist:
Oksüdeerumine
Oksüdeerimine on reaktsioon, kus hapnik ühineb teise elemendiga, saades metallide korral oksiidi ja mittemetalliliste elementidega oksihappe. Reaktsioon on aeglane ja materjali temperatuur ei tõuse.

Põlemine
Põlemine on kiire oksüdeerumise vorm, mille käigus eraldatakse ka valgust ja soojust, see tähendab, et see on eksogeenne reaktsioon.
Leelistamine
See on siis, kui metall ühineb hüdroksüülradikaaliga (radikaal -OH-vormiga).
Hapestumine
See on siis, kui mittemetalliline element kombineeritakse vesinikuga
Neutraliseerimine
See on hüdroksiidi ja happe kombinatsioon, mille tulemuseks on vee ja soola moodustumine.
Reduktsioon
See on hapniku eemaldamine oksiidist, et saada puhas metall, reageerides happega vesinikuga.
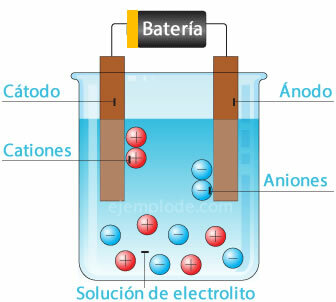
Ioniseerimine
Soola lahustamisel vees eraldatakse selle moodustavad elemendid elektrilaengutega aatomiteks, mis võivad olla positiivsed (katioon) või negatiivsed (anioon). Seda tüüpi lahuseid nimetatakse elektrolüütideks.
Elektrolüüs
Elektrivoolu juhtimisel läbi elektrolüüdi põhjustab elektrienergia aatomite eraldumist veest. positiivse laenguga vesinikioon, mis läheb negatiivsesse poolusesse (katood), ja negatiivse laenguga hapnik, mis läheb poolusesse positiivne (anood). Elektrolüüsi rakendamisel happes on üks mõju metallelemendi asendamine anoodiga.
Katalüüs
Kaks ainet, mis üldistes tingimustes ei reageeri või toimivad väga aeglaselt, võivad sisse reageerida väga kiiresti kolmanda aine juuresolekul, milles ei toimu muutusi ei enne, ega selle ajal reaktsioon. Seda tüüpi aineid nimetatakse katalüsaatoriteks.
Kääritamine
See on keemiliste muutuste saamine, eriti orgaanilistes ühendites, bakterite toimel.
Keemiliste nähtuste näide:
1. Värvimata grill puutub kokku õhus ja vees oleva hapnikuga ning hakkab roostetama (oksüdeeruma)
2. Kui tuua puit tulele lähemale, põhjustab see põlemist, põhjustades osa süsiniku molekulidest, millest see koosneb segatakse kiiresti hapnikuga, eraldades süsinikdioksiidi, jäägiks jääb põlenud puit ja tahm (põlemine)
3. Toidu lagunemine on tingitud bakterite seedetraktist, mis muudab komponentide keemilist struktuuri. (Kääritamine).
4. Auto aku toodab elektrolüüdi reaktsiooni abil elektrolüüdi ja metallelementide vahel, millega see moodustub, põhjustades elektrit tootvate ioonide vabanemist. Selle laadimiseks teostab vooluvool elektrolüütilise toimingu, mis tagastab ioonid plaatidele.
5. Automootori tekitatud gaasid on stabiilsed ja pärast mootorist lahkumist ja toatemperatuuri saavutamist peaaegu ei lagune. Katalüüsmuundur sisaldab plaatinavahtu, mis umbes 500 ° C juures kuumutamisel laske gaasidel laguneda lihtsamateks ühenditeks, ilma et plaatina toimuks muudatused.
6. Lahustades soola vees, jaguneb see naatriumi- ja klooriioonideks.
7. Sidrunimahla ja sooda segamisel tekkiv kihisemine on neutraliseerimisreaktsioon.
8. Verejooksu korral muutub veri punastes verelibledes leiduva raua oksüdeerumise tõttu tumedamaks. Seetõttu on veeniveri tumedam ja arteriaalne veri heledam.
9. Autode osade kroomimine kasutab elektrolüüsi abil kroomi kroomitud metallosale.
10. Seedimisel kui keemilisel nähtusel on vesinikkloriidhappe toimel toidule lagundada neid moodustavad kompleksmolekulid väiksemateks molekulideks, mida saab hõlpsamini imenduda soolestik.

