Exemple de liaison covalente
Chimie / / July 04, 2021
le Une liaison covalente est celui dans lequel deux atomes s'unissent en partageant leurs électrons, pour aller compléter ses Règles de l'Octet.
Histoire de la liaison covalente
C'est au début du 20e siècle que les chimistes ont commencé à comprendre comment et pourquoi les molécules se sont formées. La première percée majeure est venue avec la proposition de Gilbert Lewis de quoi la formation d'une liaison chimique implique que les atomes partagent des électrons. Lewis a décrit la formation d'une liaison chimique dans l'hydrogène comme suit :
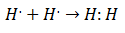
Ce type d'appariement électronique est un exemple de liaison covalente, une liaison dans laquelle deux électrons sont partagés par deux atomes. Les Composés covalents Ils sont ça ne contiennent que des liaisons covalentes.
Électrons dans la liaison covalente
Pour simplifier, le paire d'électrons partagée est souvent représenté comme une seule ligne reliant les symboles des éléments. Ainsi, la liaison covalente de la molécule d'hydrogène s'écrit H-H.
Dans la liaison covalente, chaque électron de la paire partagée
est attiré par les noyaux des deux atomes. Cette attraction maintient ensemble les deux atomes de la molécule H.2 et il est responsable de la formation de liaisons covalentes dans d'autres molécules.Dans les liaisons covalentes entre les atomes de plusieurs électrons seuls les électrons de valence participent, qui sont les plus externes, dans l'orbite la moins profonde. Entre un et trois d'entre eux participeront au syndicat.
Les autres électrons, qui ne participent pas à la liaison, sont appelés Électrons non-liants, ou si nous les organisons par paires, Paires libres. C'est-à-dire des paires d'électrons de Valence qui ne participe pas à la formation de liaison covalente.
Représentation de la liaison covalente
Les structures avec lesquelles les composés covalents sont représentés, tels que H2 et F2 sont connus comme Structures de Lewis. Une structure de Lewis est un représentation d'une liaison covalente, où la paire d'électrons partagés indiqué par des lignes ou par des paires de points entre deux atomes, et les paires libres non partagées sont indiquées comme des paires de points sur les atomes individuels. Dans une structure de Lewis, seuls les électrons de valence sont représentés, et non les électrons internes.
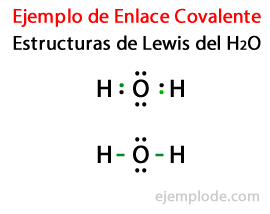
Considérant la structure de Lewis pour la molécule d'eau H2Ou, tous les électrons de valence des atomes d'hydrogène et d'oxygène sont marqués d'abord par des points.
Dans un second cas, le lien est marqué d'un trait. Et les couples libres, qui n'existeront que dans Oxygen, avec des points.
La règle de l'octuor
La formation de ces molécules, comme celles de l'Eau H2Ou illustrer l'appel Règle de l'octet, proposé par Lewis: Un atome autre que l'hydrogène a tendance à former des liaisons jusqu'à ce qu'il s'entoure de huit électrons de valenceC'est-à-dire qu'une liaison covalente se forme lorsqu'il n'y a pas assez d'électrons pour chaque atome individuel pour compléter son octet.
En partageant des électrons dans une liaison covalente, chaque atome complète son octet. Pour l'hydrogène, l'exigence est que vous obteniez la configuration électronique de l'hélium, qui doit avoir un total de deux électrons.
La règle de l'octet fonctionne principalement pour les éléments de la deuxième période ou ligne du tableau périodique. Ces éléments ont des sous-niveaux dans lesquels il peut y avoir un total de huit électrons.
Lorsqu'un atome de ces éléments forme un composé covalent, il obtient la configuration électronique du gaz noble au néon, partageant des électrons avec d'autres atomes du même composé.
Types de liaisons covalentes
Les atomes peuvent former différents types de liaisons covalentes: Simples, Doubles ou Triples.
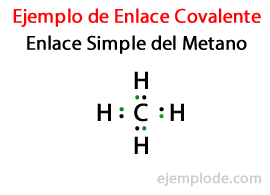
En un Lien simple, deux atomes sont liés au moyen de Une paire d'électrons. Ils se produisent dans la grande majorité des composés covalents, et c'est la forme la plus basique de cette liaison.
Dans de nombreux composés, Liens doubles, c'est-à-dire lorsque deux atomes partagent Deux paires d'électrons. Si deux atomes partagent deux paires d'électrons, la liaison covalente est appelée une double liaison. Ces liaisons se trouvent dans des molécules comme le dioxyde de carbone (CO2) et de l'éthylène (C2H4).

UNE Lien triple survient lorsque deux atomes partagent Trois paires d'électrons, comme dans la molécule d'azote N2, la molécule d'acétylène C2H2.

Les liaisons multiples sont plus courtes que les liaisons covalentes simples. La Longueur du lien est défini comme le distance entre le noyau de deux atomes joints par une liaison covalente dans une molécule.
Différences entre les composés covalents et ioniques
Les composés ioniques et covalents présentent des différences marquées dans leurs propriétés physiques générales, du fait que leurs liaisons sont de nature différente.
Dans les Composés covalents exister deux types de forces attractives; l'un d'eux est celui qui maintient les atomes d'une molécule ensemble. Une mesure quantitative de cette attraction est la énergie de liaison. L'autre force d'attraction opère entre les molécules complètes, et s'appelle Force intermoléculaire. Étant donné que les forces intermoléculaires sont généralement plus faibles que les forces qui maintiennent les atomes d'une molécule ensemble, les molécules d'un composé covalent se lient avec moins de force.
En conséquence, les composés covalents sont presque toujours des gaz, des liquides ou des solides à bas point de fusionn.m. D'autre part, les forces électrostatiques qui maintiennent les ions ensemble dans un composé ionique, ils sont généralement très forts, de sorte que les composés ioniques sont solides à température ambiante et ont des points de fusion élevés. De nombreux composés ioniques sont solubles dans l'eau et leurs solutions aqueuses conduisent l'électricité car ces composés sont des électrolytes puissants.
La plupart les composés covalents sont insolubles dans l'eau, et s'ils se dissolvent, ses solutions aqueuses comme d'habitude ils ne conduisent pas l'électricité car ces composés ne sont pas des électrolytes. Les composés ioniques fondus conduisent l'électricité car ils contiennent des cations et des anions qui se déplacent librement; les composés covalents liquides ou fondus ne conduisent pas l'électricité car il n'y a pas d'ions présents.
Exemples de composés liés par covalence
- Acétylène C2H2
- Méthane CH4
- Éthane C2H6
- Propane C3H8
- Butane C4H10
- Benzène C6H6
- Toluène C7H8
- Alcool méthylique CH3Oh
- Alcool éthylique C2H5Oh
- Alcool propylique C3H7Oh
- Éther méthylique CH3LCO3
- Éther de méthyle et d'éthyle C2H5LCO3
- Éther éthylique C2H5CO2H5
- Acide formique HCOOH
- Acide acétique CH3COOH
- Acide propionique C2H5COOH
- Acide butyrique C3H7COOH
- Dioxyde de carbone CO2
- Monoxyde de carbone CO
- Azote moléculaire N2
- Hydrogène moléculaire H2


