Exemple de Nomenclature de Composés Organiques
Chimie / / July 04, 2021
Les composés organiques sont des molécules dont la caractéristique est d'être formées par une base de molécules de carbone et l'hydrogène, également connu sous le nom de squelette, et combiné avec d'autres éléments, principalement l'oxygène, l'azote et le soufre.
La IUPAC (Union internationale de chimie pure et appliquée, Union internationale de chimie pure et appliquée) a établi des règles générales pour la classification et la nomenclature des molécules organiques, dont nous expliquons les plus importantes.
Hydrocarbures
Les hydrocarbures sont les molécules organiques les plus simples, constituées d'un squelette carboné et d'atomes d'hydrogène. Il existe trois types d'hydrocarbures :
Alcanes
Ce sont les plus simples, formés d'atomes de carbone reliés par de simples liaisons covalentes aux atomes de l'hydrogène, avec la formulation générale H = 2n + 2, c'est-à-dire que les atomes d'hydrogène sont deux fois plus nombreux que les atomes d'hydrogène. carbone, plus 2. Sa nomenclature est formée des préfixes numériques met- pour 1 atome de carbone, et- pour 2, prop- pour 3 et but- pour 4; à partir de 5 atomes de carbone, les préfixes communs pent-, hex-, hept-, oct-, etc. sont utilisés. À tous les alcanes, la terminaison -ano est ajoutée.
Exemple: CH4: méthane; C2H6: éthane; C4H10: butane; C6H14: hexane
Alcènes
Ils sont formés d'un squelette carboné dans lequel existe une double liaison entre les atomes de carbone. Sa formule générale est H = 2n, c'est-à-dire que ses atomes d'hydrogène sont le double du nombre d'atomes de carbone. Comme les alcanes, ils utilisent des préfixes qui indiquent leur nombre d'atomes de carbone, et dans ce cas la terminaison -eno est ajoutée. De plus, dans les molécules à plus de trois atomes de carbone, la carbone où se trouve la double liaison, en commençant à compter à partir du carbone le plus proche de est.
Exemples: C2H4: éthène; C3H6: propène; C4H8: butène, 2-butène; C6H12: Hexène, 2-hexène (double liaison à l'atome 2), 3-hexène (double liaison à l'atome 3).
Alcynes
Les alcynes contiennent une triple liaison à leurs atomes de carbone. Sa formule générale est H = 2n-2, indiquant que la molécule contiendra deux atomes d'hydrogène moins de deux fois le nombre d'atomes de carbone. Au préfixe qui indique le nombre de carbones, la terminaison -ino est ajoutée. Comme dans le cas des alcènes, le carbone contenant la triple liaison est mentionné, compté à partir de l'extrême le plus proche de celui-ci.
Exemples: C2H2: éthyne; C3H4: Astuce; C4H6: butyne, 2-butyne; C6H12: Hexino, 2-hexène (triple liaison à l'atome 2), 3-hexyne (triple liaison à l'atome 3).
Groupes fonctionnels
Les groupes fonctionnels sont des combinaisons d'atomes qui fonctionnent comme un ion et remplacent un atome d'hydrogène dans la formule d'un alcane.
Radicaux
L'alcane sans l'atome d'hydrogène est appelé Radical, et pour l'identifier la terminaison -ilo est ajoutée :
Exemples CH4: méthane - CH3+ méthyle; C2H6: éthane - C2H5+ éthyle; C4H10: butane - C4H9+ butyle; C6H14: hexane - C6H13+ hexyle.
Combinaison d'hydrocarbures
L'un des cas qui peuvent se produire est que deux ou plusieurs hydrocarbures sont combinés dans une molécule. Les hydrocarbures avec lesquels il est combiné sont appelés arborescences. Dans ces cas, l'hydrocarbure de base sera celui avec la chaîne la plus longue, et le nombre de carbone où on trouve les arborescences, suivies du nom du radical avec la terminaison -il, puis du nom de l'hydrocarbure base. Le numéro sera mentionné autant de fois que les arbres qui y sont attachés. Dans le cas où les arborescences sont du même radical dans des atomes de carbone différents, les nombres séparés par des virgules seront mentionnés, suivis d'un tiret, le nom du radical, puis les numéros des atomes où est rattaché l'autre radical, le cas échéant, un tiret, le nom du radical et le nom de l'hydrocarbure base. Dans le cas où il y a deux radicaux attachés au même atome de carbone, le nombre sera mentionné deux fois. S'il s'agit de radicaux différents, alors il sera mentionné une fois avant le nom de chaque radical; si les radicaux sont égaux, le nombre sera mentionné deux fois. Nous commencerons par mentionner d'abord les arborescences les plus simples (celles avec le moins de carbones) et ensuite celles avec le plus grand nombre.
Exemple: Une molécule de pentane, avec deux radicaux éthane, liés aux carbones 2 et 3 :
2,3-éthyl pentane. Une molécule d'octane, un radical propane au carbone 6, des radicaux méthane aux carbones 4 et 5 et des radicaux éthane, liés aux carbones 2, 3 et 4: 4,5-méthyl-2,3,4-éthyl-6-propyle -octane.
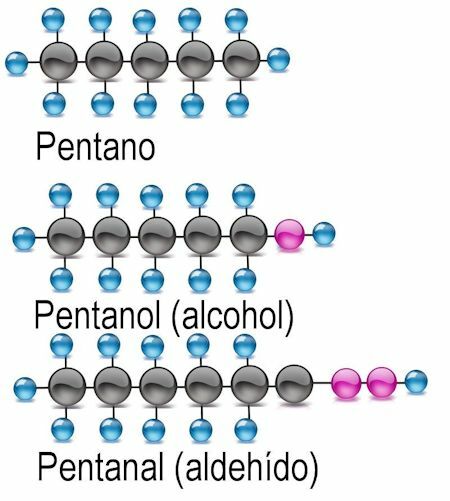
Groupe fonctionnel alcool
Le plus simple des groupes fonctionnels est l'alcool, dans lequel un atome d'hydrogène est remplacé par un groupe hydroxyle (OH). Dans ces composés, la terminaison -anol est ajoutée au nom du radical. Le cas échéant, l'atome de carbone où se trouve le groupe fonctionnel doit être mentionné :
Exemples CH3OH: méthanol: C2H5OH éthanol; C4H9OH butanol ou 2-butanol; C6H13OH hexanol, 2-hexanol (groupe fonctionnel à l'atome 2), 3-hexanol (groupe fonctionnel à l'atome 3).
Groupe fonctionnel aldéhyde
Dans les aldéhydes, l'atome d'hydrogène est échangé contre le groupe fonctionnel -CHO. Pour les identifier, la terminaison -anal est ajoutée, et l'atome de carbone où se trouve le groupe fonctionnel est également mentionné :
Exemples CH3COH: méthanal: C2H5Éthanal COH; C4H9COH butanal ou 2-butanal; C6H13COH hexanal, 2-hexanal (groupe fonctionnel à l'atome 2), 3-hexanal (groupe fonctionnel à l'atome 3).
Groupe fonctionnel acide
Dans les acides organiques, l'atome d'hydrogène est échangé contre le groupe fonctionnel -COOH. Pour les identifier, le mot acide est mentionné et la terminaison -anoïque est ajoutée, et l'atome de carbone où se trouve le groupe fonctionnel est également mentionné :
Exemples CH3COOH: acide méthanoïque: C2H5COOH acide éthanoïque; C4H9COOH acide butanoïque ou acide 2-butanoïque; C6H13COH acide hexanoïque, acide 2-hexanoïque (groupe fonctionnel à l'atome 2), acide 3-hexanoïque (groupe fonctionnel à l'atome 3).

