Voorbeeld van covalente binding
Chemie / / July 04, 2021
De Covalente binding is degene waarin twee atomen verenigen zich door hun elektronen te delen, om het reglement van het Octet te gaan voltooien.
Geschiedenis van de covalente binding
Het was in het begin van de 20e eeuw dat scheikundigen begonnen te begrijpen hoe en waarom moleculen werden gevormd. De eerste grote doorbraak kwam met het voorstel van Gilbert Lewis over wat de vorming van een chemische binding houdt in dat atomen delen elektronen. Lewis beschreef de vorming van een chemische binding in waterstof als:
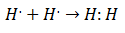
Dit type elektronenparen is een voorbeeld van een covalente binding, een binding waarin: twee elektronen worden gedeeld door twee atomen. De Covalente verbindingen Dat zijn ze bevatten alleen covalente bindingen.
Elektronen in de covalente binding
Voor de eenvoud, de gedeeld elektronenpaar wordt vaak weergegeven als enkele lijn het verbinden van de symbolen van de elementen. De covalente binding van het waterstofmolecuul wordt dus geschreven als H-H.
In de covalente binding, elk elektron van het gedeelde paar
wordt aangetrokken door de kernen van beide atomen. Deze aantrekkingskracht houdt de twee atomen in het H-molecuul bij elkaar.2 en het is verantwoordelijk voor de vorming van covalente bindingen in andere moleculen.In de covalente bindingen tussen atomen van meerdere elektronen alleen valentie-elektronen nemen deel, die de buitenste zijn, in de ondiepste orbitaal. Tussen de één en drie van hen zullen deelnemen aan de vakbond.
De andere elektronen, die niet deelnemen aan de binding, worden genoemd Niet-bindende elektronen, of als we ze in paren organiseren, Gratis paren. Dat wil zeggen, paren Valencia Electrons die doe niet mee aan Covalente Bond Formation.
Covalente bindingsrepresentatie
De structuren waarmee covalente verbindingen worden weergegeven, zoals H2 en F2 staan bekend als Lewis-structuren. Een Lewis-structuur is a weergave van een covalente binding, waarbij het paar gedeelde elektronen aangegeven door lijnen of als puntenparen tussen twee atomen, en de ongedeelde vrije paren worden aangegeven als puntenparen op de individuele atomen. In een Lewis-structuur worden alleen de valentie-elektronen weergegeven, en niet de interne.
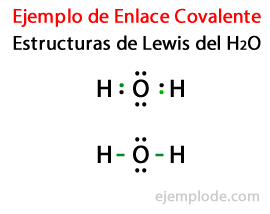
Gezien de Lewis-structuur voor het watermolecuul H2Of alle valentie-elektronen van de waterstof- en zuurstofatomen worden eerst gemarkeerd met stippen.
In een tweede geval is de link gemarkeerd met een lijn. En de gratis paren, die alleen in Oxygen zullen bestaan, met punten.
De regel van het Octet
De vorming van deze moleculen, zoals die van Water H2Of illustreer de oproep Octetregel, voorgesteld door Lewis: Een ander atoom dan waterstof heeft de neiging om bindingen te vormen totdat het zichzelf omringt met acht valentie-elektronenDat wil zeggen, een covalente binding vormt zich wanneer er niet genoeg elektronen zijn voor elk afzonderlijk atoom om zijn octet te voltooien.
Door elektronen te delen in een covalente binding, elk atoom voltooit zijn octet. Voor waterstof is de vereiste dat u de elektronische configuratie van helium verkrijgt, die in totaal twee elektronen moet hebben.
De octetregel werkt voornamelijk voor de elementen van de tweede periode of rij van het periodiek systeem. Deze elementen hebben subniveaus waarin er in totaal acht elektronen kunnen zijn.
Wanneer een atoom van deze elementen een covalente verbinding vormt, verkrijgt het de elektronische configuratie van het neonedelgas en deelt het elektronen met andere atomen in dezelfde verbinding.
Soorten covalente obligaties
Atomen kunnen verschillende soorten covalente bindingen vormen: Eenpersoons-, tweepersoons- of driepersoonskamers.
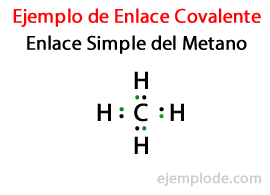
In een Eenvoudige link, twee atomen zijn verbonden door middel van Een paar elektronen. Ze komen voor in de overgrote meerderheid van covalente verbindingen en het is de meest basale vorm van deze binding.
In veel verbindingen, Dubbele links, dat wil zeggen, wanneer twee atomen delen Twee paar elektronen. Als twee atomen twee paar elektronen delen, wordt de covalente binding een dubbele binding genoemd. Deze bindingen worden gevonden in moleculen zoals koolstofdioxide (CO2) en ethyleen (C2H4).

EEN Drievoudige link ontstaat wanneer twee atomen delen Drie paar elektronen, zoals in het stikstofmolecuul N2, het Acetyleen C-molecuul2H2.

Meerdere bindingen zijn korter dan enkelvoudige covalente bindingen. De Link lengte wordt gedefinieerd als de afstand tussen de kern van twee verbonden atomen door een covalente binding in een molecuul.
Verschillen tussen covalente en ionische verbindingen
Ionische en covalente verbindingen vertonen duidelijke verschillen in hun algemene fysische eigenschappen, vanwege het feit dat hun bindingen van verschillende aard zijn.
In de Covalente verbindingen bestaan twee soorten aantrekkingskrachten; een van hen is degene die de atomen van een molecuul bij elkaar houdt. Een kwantitatieve maatstaf voor deze aantrekkingskracht is de bindende energie. De andere aantrekkingskracht werkt tussen de volledige moleculen, en wordt genoemd Intermoleculaire kracht. Omdat intermoleculaire krachten meestal zwakker zijn dan de krachten die de atomen van een molecuul bij elkaar houden, binden de moleculen van een covalente verbinding met minder kracht.
Met als gevolg, covalente verbindingen zijn bijna altijd laagsmeltende gassen, vloeistoffen of vaste stoffenzn. Aan de andere kant, de elektrostatische krachten die de ionen bij elkaar houden in een ionische verbinding zijn ze meestal erg sterk, zodat ionische verbindingen vast zijn bij kamertemperatuur en hoge smeltpunten hebben. Veel ionische verbindingen zijn oplosbaar in water en hun waterige oplossingen geleiden elektriciteit omdat deze verbindingen sterke elektrolyten zijn.
Meeste van de covalente verbindingen zijn onoplosbaar in wateren als ze oplossen, zijn waterige oplossingen zoals gewoonlijk ze geleiden geen elektriciteit omdat deze verbindingen niet-elektrolyten zijn. Gesmolten ionische verbindingen geleiden elektriciteit omdat ze kationen en anionen bevatten die vrij kunnen bewegen; vloeibare of gesmolten covalente verbindingen geleiden geen elektriciteit omdat er geen ionen aanwezig zijn.
Voorbeelden van covalent gebonden verbindingen
- Acetyleen C2H2
- Methaan CH4
- ethaan C2H6
- propaan C3H8
- Butaan C4H10
- benzeen C6H6
- Tolueen C7H8
- Methylalcohol CH3Oh
- Ethylalcohol C2H5Oh
- Propylalcohol C3H7Oh
- Methylether CH3OCH3
- Methyl Ethyl Ether C2H5OCH3
- Ethyl Ether C2H5OC2H5
- Mierenzuur HCOOH
- Azijnzuur CH3COOH
- Propionzuur C2H5COOH
- Boterzuur C3H7COOH
- Kooldioxide CO2
- Koolmonoxide CO
- Moleculaire stikstof N2
- Moleculair waterstof H2
