Voorbeeld van organische chemie
Chemie / / July 04, 2021
De Organische chemie Het is het deel van de Algemene Chemie dat verantwoordelijk is voor de studie en de functionele classificatie van chemische verbindingen waarvan het structurele element de. is Koolstof, in overvloed aanwezig in de levende materie; Dit creëert een zeer gedifferentieerd universum van anorganische chemie, gewijd aan chemische verbindingen die als mineralen zijn geclassificeerd.
Het koolstofatoom heeft vier elektronen in de laatste schil van zijn elektronische configuratie. Deze eigenschap, samen met die van zijn atomaire straal, maakt het mogelijk om door covalente bindingen te worden verbonden met andere atomen van hetzelfde element, in talrijke ketens, die een grote diversiteit aan chemische verbindingen vormen stal.
Je kunt controleren Covalente bindingen.
Dergelijke chemische verbindingen bevatten, naast de koolstofatomen die ze hun oorspronkelijke structuur geven, waterstofatomen als de belangrijkste aanvulling voor de koolstofvalentie. Bovendien zijn er in deze diversiteit aan verbindingen die met tussenkomst van zuurstofatomen, Stikstof, Halogenen, Zwavel en zelfs Fosfor, alkali- en aardalkali-elementen en metalen van overgang. Afhankelijk van wie er bij het molecuul betrokken is, zijn dit de fysische en chemische eigenschappen van de uiteindelijke stof.
De organische bestanddelen zijn overal aanwezig levende materie; iedereen promoten en ondersteunen biologische functies, in tegenstelling tot anorganische of minerale stoffen, die door mensen zijn gebruikt voor commerciële doeleinden, voor experimenten of om bepaalde huishoudelijke taken te vervullen.
Geschiedenis van de organische chemie
Al vóór 1828 werd het onderscheid gemaakt tussen organische chemie en anorganische chemie. Organische stof werd geassocieerd met een creatie door middel van een "levenskracht", en het anorganische met het niet-levende, met het minerale. Gezien deze opvattingen kon men in het laboratorium niet verwachten dat organische verbindingen uit anorganische materialen zouden worden verkregen.
Echter, in 1828 Friedrich Wöhler (1800-1882) slaagde erin een organische stof te bereiden, Ureum CO (NH2)2, een belangrijk product van het dierlijke metabolisme, uit anorganische verbindingen. Behandeling Loodcyanaat Pb (CNO)2 met Ammoniak NH3 krijgen Ammoniumcyanaat NH4CNO; Deze verbinding werd inderdaad gevormd, maar toen de oplossing werd gekookt om het ammoniumcyanaat te kristalliseren, werd het omgezet in ureum.
Deze chemische verandering is een voorbeeld van: Interne hergroepering, waarbij het aantal of de klasse van atomen in het molecuul niet verandert, maar alleen hun volgorde erin. Dit soort transformaties komt veel voor in de organische chemie.
Wöhlers ontdekking leidde later tot het opgeven van de levenskrachttheorie force volledig weggegooid door te worden gevolgd door de bereiding van vele andere organische verbindingen in de laboratorium. Desondanks blijven de kwalificaties van anorganisch en organisch bestaan, aangezien anorganische verbindingen gerelateerd zijn aan minerale producten en organische verbindingen, die in feite verbindingen zijn van koolstof en waterstof en hun derivaten, zijn van het type dat door levende organismen wordt geproduceerd.
Hoewel de wetten van de algemene scheikunde op beide verbindingen gelijkelijk van toepassing zijn, rechtvaardigen en maken verschillende oorzaken deze verdeling noodzakelijk. Zo verschillen organische en anorganische verbindingen in verschillende eigenschappen, zoals: hun oplosbaarheid voorkeur in organische oplosmiddelen (ether, alcohol, chloroform, enz.) en in water, respectievelijk, Stabiliteit (organische verbindingen ontleden bij relatief lage temperaturen), en de Aard van reacties; voor anorganische verbindingen zijn ze ionisch, eenvoudig en praktisch onmiddellijk, en voor organische verbindingen zijn ze covalent, complex en langzaam.
Organische bestanddelen
Er zijn koolstofverbindingen met ketens tot negentig atomen bekend. De kettingen Koolstofatomen kunnen lineair en vertakt en hebben enkelvoudige covalente bindingen of hebben dubbele of driedubbele bindingen. Van meer dan 2500 verbindingen is bekend dat ze alleen koolstof en waterstof bevatten (Koolwaterstoffen).
Isomerie van organische verbindingen
In anorganische verbindingen stelt een formule in het algemeen een enkele verbinding voor; er is dus maar één stof met formule H2SW4. Het zwavelzuurmolecuul bevat twee waterstofatomen, één van zwavel en vier van zuurstof, in een specifieke en unieke rangschikking. In organische verbindingen is het: zeldzaam dat dit gebeurt. Zo zijn er bijvoorbeeld twee verbindingen die reageren op de formule C2H6Of ethylalcohol of ethanol en dimethylether.

Hoe complexer het molecuul, dat wil zeggen, hoe groter het aantal koolstofatomen, hoe groter het aantal mogelijke isomeren.
Analyse van organische verbindingen
De analyse van een organische verbinding omvat de kwalitatieve analyse, de kwantitatieve analyse en de Functionele analyse. In het geval dat de verbinding zich in een onzuivere staat bevindt, wordt deze vooraf gezuiverd door: Kristallisatie, Distillatie, sublimatie, Extractie, enz. Het zuiverheidscriterium kan worden beoordeeld op basis van de fysische constanten, zoals smeltpunt, kookpunt, dichtheid, oplosbaarheid, kristallijne vorm, brekingsindex, enz.
De kwalitatieve analyse Het wordt geverifieerd door de aanwezigheid van de elementen waaruit de verbinding bestaat te onderzoeken, met name koolstof, waterstof en stikstof, en soms halogeen, zwavel en fosfor.
De kwantitatieve analyse Het wordt uitgevoerd op basis van de methoden die worden gebruikt voor kwalitatieve analyse. Het uitgangspunt is een bepaalde hoeveelheid stof die verbranding ondergaat en de kooldioxide wordt opgevangen en gewogen. koolstof en waterdamp gevormd om het percentage koolstof en waterstof in de. te berekenen verbinding. De resultaten van de kwantitatieve analyse vergemakkelijken de berekening van de empirische formule, hoewel de molecuulformule alleen kan worden gevonden na de bepaling van het molecuulgewicht van de stof. Maar het probleem is nog niet opgelost, omdat dezelfde molecuulformule kan corresponderen met verschillende isomeren.
Classificatie van organische verbindingen
Volgens hun structuur worden organische verbindingen onderverdeeld in verbindingen: alifatisch, aromatisch Y heterocyclisch. Alifatische verbindingen zijn gerelateerd aan methaan CH4, zijn open keten, behalve cycloparaffinen, en danken hun naam aan het feit dat dierlijke en plantaardige vetten tot deze groep behoren.
De aromatische verbindingen, gesloten keten, nauw verwant aan benzeen, C6H6, en ze danken hun naam aan het feit dat velen van hen geurige, aangename geuren hebben.
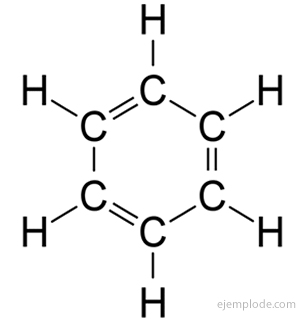
Benzeenring
De heterocyclische verbindingen Het zijn verbindingen met een gesloten keten waarin zich een ander element dan koolstof in de ring bevindt.
Volgens hun grondwet zijn ze:
Koolwaterstoffen, die op zijn beurt, vanwege het type links dat het heeft, wordt geclassificeerd als Alkanen, alkenen Y Alkynen. Bovendien vallen cycloalkanen, benzeen en hun derivaten die alleen uit koolstof en waterstof bestaan, in deze categorie.
Heterocyclische verbindingen
Gehalogeneerde derivaten:R-X
Nitro verbindingen:R-NEE2
Sulfonzuren:R-SO3H
Nitrillen (OF alkylcyaniden) en isonitrilen:R-CN en R-NC. Ze verschillen in hoe het stikstofatoom in het molecuul is gebonden.
Alcoholen:R-OH
fenolen: Verbindingen op basis van een ruggengraat bestaande uit een benzeenring met een toegevoegde hydroxylgroep.

ether:R-O-R
Mercaptanen: R-SH
Thiethers:R-S-R
Thiozuren:R-COSH
Aldehyden:R-CHO
ketonen:R-CO-R
Carbonzuren:R-COOH
Je gaat uit:R-COOM (M voor metaal)
Esters: R-COO-R
Anhydriden: R-CO-O-OC-R
Aminen:R-NH2, R-NH-R, 2R-N-R
Aldosa-type koolhydraten:-CHOH-CHOH-CHO
Koolhydraten van het ketose-type:-CHOH-CO-CH2Oh
Organometaalverbindingen:R-M-R
Metaal-alkylhalogeniden:R-MX (ook bekend als Grignard-reagentia)