100 przykładów pierwiastków chemicznych
Różne / / November 13, 2021
ten pierwiastki chemiczne są rodzajem spraw, które bez żadnej procedury lub Reakcja chemiczna można je redukować lub rozkładać na inne prostsze elementy. Z tego powodu można powiedzieć, że element jest wszystkim materiał zrobione przez atomy tej samej i unikalnej klasy, to znaczy atomów, które mają tę samą liczbę atomową (równą liczbę protonów), chociaż mają różną masę atomową. Na przykład: siarka, bor, chrom, cyna.
Pierwsza definicja pierwiastka chemicznego została wprowadzona przez Lavoisier w Traite Élémentaire de Chimie, w 1789 roku. W XVIII wieku Lavoisier podzielił proste substancje na cztery grupy:
Układ okresowy pierwiastków
Dziś się znają 118 pierwiastków chemicznych. Wszystkie są gromadzone, klasyfikowane i porządkowane według wielu ich właściwości w schemacie graficznym znanym jako układ okresowy pierwiastków, który został pierwotnie stworzony przez rosyjskiego chemika Dymitr Mendelejew w 1869 roku. Układ okresowy składa się z 18 grup (kolumn) i 7 okresów (wierszy), w których znajdują się pierwiastki chemiczne.
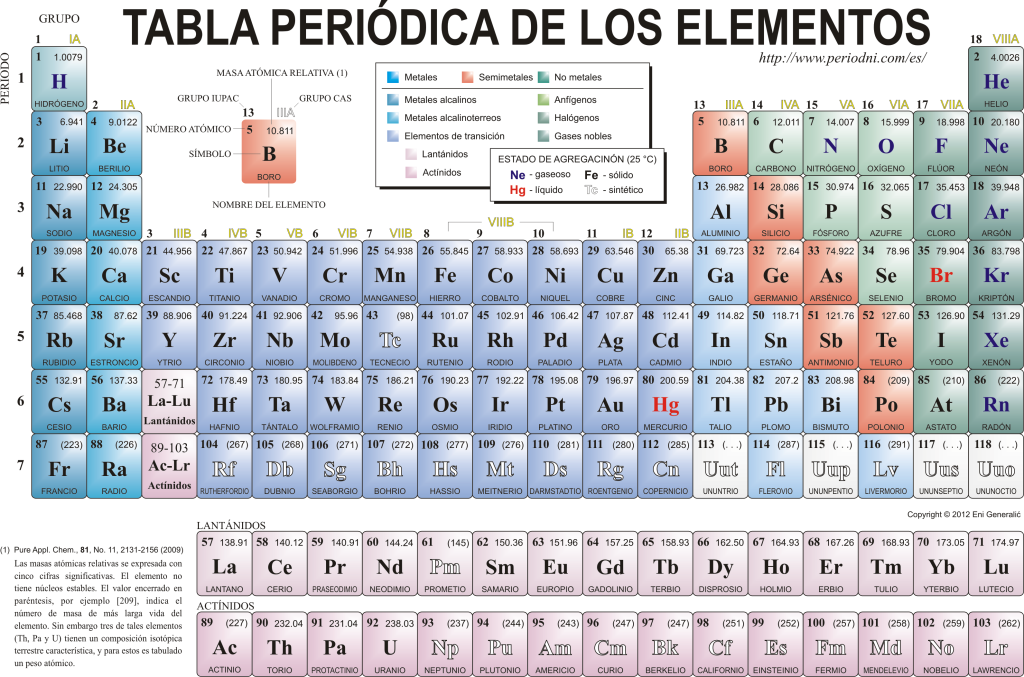
ten główne grupy które można znaleźć w tej tabeli to:
Metale alkaliczne (Grupa 1), metale ziem alkalicznych (Grupa 2), rodzina skandu, która obejmuje ziemie i aktynowce (Grupa 3), rodzina tytanu (Grupa 4), rodzina wanadu (Grupa 5), rodzina chromu (Grupa 6), rodzina manganu (Grupa 7), rodzina żelaza (Grupa 8), rodzina kobaltu (Grupa 9), rodzina niklu (Grupa 10), rodzina miedzi (Grupa 11), rodzina cynku (Grupa 12), pierwiastki ziem (Grupa 13), pierwiastki węglowe, w tej grupie jest Węgiel, który stanowi podstawę życia na Ziemi (grupa 14), pierwiastki tworzące azot (grupa 15), pierwiastki amfigenetyczne, zawiera tlen, pierwiastek podstawowy dla ten oddechowy z żyjące istoty (Grupa 16), pierwiastki halogenowe (Grupa 17) i gazy szlachetne (Grupa 18).
Wiele z tych elementów ma izotopy stabilne lub radioaktywne, czyli ten sam pierwiastek chemiczny, na przykład wodór (H), może mieć kilka izotopów (1H, 2H, 3H). Oznacza to, że każdy atom izotopu ma taką samą liczbę protonów (co oznacza, że należy do tego samego pierwiastka chemicznego) i inną liczbę neutronów.
Niektóre izotopy nie są stabilne (radioaktywne), to znaczy rozpadać się w określonym czasie, emitując określone cząstki (m.in. neutrony, fotony, cząstki alfa) i generując inne stabilne lub radioaktywne izotopy. Pierwiastki chemiczne mają właściwości takie jak punkt wrzenie i to z połączenie, elektroujemność, gęstość i m.in. promień jonowy. Te właściwości są ważne, ponieważ pozwalają przewidzieć jego zachowanie, reaktywność itp.
Jak prezentują się pierwiastki w układzie okresowym?
Każdy pierwiastek chemiczny jest scharakteryzowany w Układ okresowy pierwiastków używając określonej symboliki. W pierwszej kolejności pośrodku każdego pudełka znajduje się jego uniwersalny symbol, który składa się z jednego lub dwóch litery (umownie, jeśli są dwie litery, pierwsza jest pisana dużymi, a następna małymi).
Powyżej i po lewej stronie pojawia się małym krojem su Liczba atomowa, czyli ten, który wskazuje ilość protonów, jakie posiada ten pierwiastek. Poniżej symbolu elementu pojawia się jego nazwa, a powyżej, po lewej stronie, jego nazwa. masa atomowa względny. Ponadto kolor, w jakim przedstawiony jest symbol pierwiastka, wskazuje na jego stan skupienia (zgodnie z przedstawieniem stosowanym w każdym układzie okresowym).
Różne obecne elementy promienie atomowe zmiennych, a wraz ze wzrostem liczby protonów w jądrze, większe przyciąganie, jakie jądro wywiera na elektrony, więc promień atomowy ma tendencję do zmniejszania się. Gdy promień atomowy jest mały, elektrony na najbardziej zewnętrznym poziomie obłoku są bardzo przyciągane do jądra, więc nie poddają się łatwo. Odwrotnie dzieje się z pierwiastkami o dużym promieniu atomowym: łatwo oddają swoje zewnętrzne elektrony.
Tak więc promień atomowy zwiększa się od góry do dołu, gdy przechodzimy przez grupy układu okresowego pierwiastków, i zmniejsza się od lewej do prawej, gdy przechodzimy przez ich okresy.
Przykłady pierwiastków chemicznych
| Pierwiastek chemiczny | Symbol |
| Aktyn | Ac |
| Aluminium | Do |
| Ameryk | JESTEM |
| Antymon | Sb |
| Argon | Ar |
| Arsen | As |
| Astat | Na |
| Siarka | S |
| Bar | Ba |
| Beryl | Być |
| Berkel | Bk |
| Bizmut | Bi |
| Bohrio | Bh |
| Bor | b |
| Brom | Br |
| Kadm | Płyta CD |
| Wapń | AC |
| Kaliforn | cf |
| Węgiel | C |
| Cer | WE |
| Cez | Cs |
| Chlor | Cl |
| Kobalt | Współ |
| Miedź | Cu |
| Chrom | Cr |
| Kiur | Cm |
| Darmstadio | Ds |
| Dysproz | Dy |
| Dubnium | Db |
| Einsteina | To jest |
| Erb | Er |
| Skand | Sc |
| Cyna | Sn |
| Stront | Pan |
| Europ | Eu |
| Ferm | Fm |
| Fluor | F |
| Mecz | P |
| Franciszka | Fr |
| Gadolin | Bóg |
| Gal | Ga |
| German | Ge |
| Hafn | Hf |
| Hassio | Hs |
| Hel | mam |
| Wodór | h |
| Żelazo | Wiara |
| Holmium | Ho |
| indyjski | w |
| Jod | i |
| Iryd | Iść |
| Iterb | Yb |
| Itr | ORAZ |
| Krypton | Kr |
| Lantan | ten |
| Lawrencio | Lr |
| Lit | Li |
| Lutet | pon |
| Magnez | Mg |
| Mangan | Mn |
| Meitnerius | Mt |
| Mendelew | Md |
| Rtęć | Hg |
| molibden | Mo |
| Neodym | Na |
| Neon | Ne |
| Neptun | Np |
| Niob | Nb |
| Nikiel | Żaden |
| Azot | n |
| Nobelio | Nie |
| Złoto | Au |
| Osm | Ty |
| Tlen | LUB |
| Paladium | PS |
| Srebro | Ag |
| Platyna | Pt |
| Ołów | Pb |
| Pluton | Pu |
| Polon | Po |
| Potas | K |
| Prazeodym | Pr |
| Obietnica | Po południu |
| Protaktyn | Rocznie |
| Radio | Ra |
| Radon | Rn |
| Ren | Odnośnie |
| Rod | Rh |
| Rubid | Rb |
| Ruten | Ru |
| Rutherfordio | Rf |
| Samar | Człek |
| Seaborgio | Sg |
| Selen | ja wiem |
| Krzem | tak |
| Sód | Na |
| Tal | Tl |
| Tantal | Ta |
| Technet | Tc |
| Tellur | Herbata |
| Terb | Tb |
| Tytan | Ty |
| Tor | NS |
| Tul | Tm |
| Kopernik | Cn |
| Livermorio | Lv |
| Roentgenio | Rg |
| Unoktium | Uuo |
| Ununpentium | Uup |
| Flerovio | Fl |
| Niepowodzenie | Uus |
| Ununtrium | Uut |
| Uran | LUB |
| Wanad | V |
| Wolfram | W |
| Ksenon | Xe |
| Cynk | Zn |
| Cyrkon | Zr |

Postępuj zgodnie z: