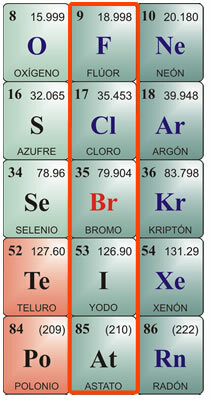
Пример химических элементов
Химия / / July 04, 2021
Химический элемент это чистое вещество, состоящее из атомов одного типа, в свою очередь сформировал количеством протонов и нейтронов в ядре, и количество электроны на своих орбиталях. Некоторые из них обнаруживаются естественным путем, другие - путем образования молекул соединения, а третьи были созданы в результате выполнения лабораторных процедур. Все химические элементы составляют материю всей вселенной и поддерживают существование и функционирование человеческого тела.
Каждый элемент имеет характеристики и поведение, которые придают ему отличия и делают его уникальным. но в то же время он представляет сходство с группой элементов в проявлении, которое они имеют в Вселенная. По этой причине существует Периодическая таблица химических элементов, которая рассматривает эти сходства, чтобы связно сгруппировать элементы и облегчить изучение их свойств.
Атомный номер элемента
Атом несет в ядре некоторое количество протонов, сопровождаемое таким же количеством нейтронов. На этот номер это называется атомным номером
, представленный как Z для академических целей и в литературе. Для каждого Элемента этот номер будет уникальным. Не существует двух Элементов с одинаковым атомным номером. Периодическая таблица также ориентируется на этот критерий для их упорядочивания.Символ элемента
Во времена алхимии, которые охватывают примерно 400–1000 гг. Нашей эры. C., алхимики записали свои эксперименты, присваивая элементам символы. Это были простые символы, состоящие из геометрических фигур, для обозначения отдельного элемента и изучаемых преобразований.
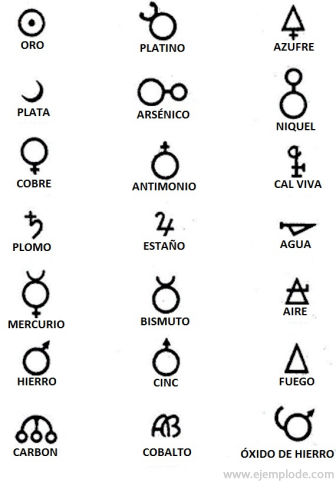
Некоторые примеры алхимических символов с названием элемента или соединения, которое они представляют.
В эпоху современной химии элементы все еще представлены символами, в данном случае буквами, обозначающими их названия на латыни или английском языке.
Например:
Символ натрия Na, по латинскому названию Натриум
Символ золота - Au, по латинскому названию Aurum
Символ серебра - Ag, по латинскому названию Аргентум
Символ меди - Cu, по латинскому названию Cuprum
Символ сурьмы - Sb, по латинскому названию Стибиум
Символ железа - это Вера, по латинскому названию Феррум
Символ Меркурия - это Hg, по латинскому названию Ртуть, что означает «жидкое серебро».
Символ калия: K, по латинскому названию Калиум
Группы химических элементов:
Периодическая таблица химических элементов классифицирует их по группам: группы A и группы B. Группы A восемь, которые содержат элементы Щелочной, то Щелочно-землистый, то Terreos, три семейства Элементов, глава которых определяет название семейства: Семья углерода, Семья азота, Семейство серы, то Галогены и благородные газы. Группы B состоят из всех Переходные металлы и Редкие Земли, которые также представляют собой две великие Семьи: Лантаноиды Y Актиниды.
Группа IA: Щелочные элементы:
Ряд щелочных элементов состоит из водорода (H), лития (Li), натрия (Na), калия (K), рубидия (Rb), цезия (Cs) и франция (Fr). Все они имеют такую электронную конфигурацию, что в последней оболочке у них есть электрон. Их название связано с тем, что при контакте с водой они реагируют с образованием щелочей или гидроксидов. Это общее поведение между этими элементами. Чем крупнее атом элемента, тем он более реактивен, поскольку сила, с которой ядро удерживает электрон от последней оболочки, имеет все меньше и меньше досягаемости. Они способны образовывать ионные связи с галогенами. Например: ионная связь, которая присутствует в большом количестве, представляет собой натрий-хлорную связь, образующую хлорид натрия. NaCl.
Группа IIA: Щелочноземельные элементы:
Эти элементы: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они несвободны по своей природе; с другой стороны, его карбонаты и силикаты существуют в относительном изобилии. Они аргентинские белые и кристаллические. Они легко соединяются с кислородом при контакте с воздухом. Частично это связано с тем, что у них есть два электрона в последней оболочке, что соответствует способности принимать кислород. Барий является наиболее активным элементом группы, и вместе с кальцием они имеют наибольшее промышленное применение в группе.
Группа IIIA: Элементы Земли:
Группа IIIA включает элементы Бор (B), Алюминий (Al), Галлий (Ga), Инд (In) и Таллий (Tl). Бор - неметаллический элемент, Алюминий - амфотерный (амфипротонный), то есть он способен действовать как кислота и как основание; а остальные три - металлические элементы. У них есть три электрона в их последней оболочке, генерируя валентность +3, хотя иногда Галлий действует с валентностью +1 и +2 в некоторых своих соединениях. Бор - единственный элемент в этой серии, который образует гидриды. Бор и алюминий образуют карбиды.
Группа IVA: Углеродное семейство:
Типичными элементами группы IVA являются углерод (C), кремний (Si), германий (Ge), олово (Sn) и свинец (Pb). Первые два принципиально неметаллические по своим характеристикам, но германий, олово и свинец являются металлическими, и тем более, чем выше их атомный номер. За исключением кремния, каждый элемент имеет валентности +4 и +2.
Углерод и кремний образуют соединения, в которых атомы элементов соединены парами общих электронов. Углерод является сущностью органических соединений, связываясь с атомами водорода, кислорода, азота, серы и иногда кремния.
Кремний и германий используются для производства электронных компонентов, поскольку они обладают свойством вести себя как полупроводники.
Группа VA: Семейство азота:
Группа VA включает элементы: азот (N), фосфор (P), мышьяк (As), сурьму (Sb) и висмут (Bi). Азот и фосфор - неметаллы, мышьяк и сурьма - металлоиды, а висмут - металл. Эти элементы характеризуются образованием гидридов, наименее токсичным из которых является аммиак NH.3. Азот образует азотную кислоту HNO3, участвует вместе с соляной кислотой в Agua Regia, смеси, способной растворять драгоценные металлы, такие как золото и серебро.
Азот также участвует в двух больших группах органических соединений, называемых аминами и амидами, которые можно рассматривать как производные аммиака NH.3путем замещения водорода углеводородной цепью.
Группа VIA: Кислородное семейство:
Состоит из элементов кислорода (O), серы (S), селена (Se), теллура (Te) и полония (Po). Кислород наиболее активен и имеет способность легко образовывать ковалентные связи. При контакте с металлами в среде с повышенной влажностью образует оксиды. Он образует резонансную молекулу под названием озон, которая защищает планету от ультрафиолетового излучения.
Группа VIIA: Галогены:
Его название означает «Формирователи продаж». Группа состоит из элементов: фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At). У них семь электронов в последней оболочке, что позволяет им быть рецепторами для одного электрона. Это свойство заставляет их связываться с элементами группы IA, образуя бинарные соли. Фтор характеризуется наибольшей электроотрицательностью во всей Периодической таблице, со значением 4,0, его аналогом является цезий, с электроотрицательностью 0,7. Это свойство позволяет ему иметь силу притягивать другие атомы и отдавать предпочтение образованию связи с Они.
Группа VIIIA: благородные газы:
Также называется группой инертных газов, она состоит из элементов гелия (He), неона (Ne), аргона (Ar), криптона (Kr), ксенона (Xe) и радона (Ra). Это элементы, которые имеют всю свою полную электронную конфигурацию, поэтому они не способны реагировать в обычных условиях. Они используются в основном для светящихся коммерческих вывесок, излучающих видимый свет, когда на них падает электрический ток.
Группы B: переходные металлы:
Переходные металлы сгруппированы в десять групп по три элемента в каждой. К ним относятся лучшие электрические проводники: серебро (Ag), медь (Cu), золото (Au); лучшие конструктивные элементы для городского строительства и инженерии; Железо (Fe), титан (Ti), алюминий (Al), цирконий (Zr), вольфрам (W); лучшие компоненты катализатора: никель (Ni), ванадий (V), платина (Pt); и основные ингредиенты покрытия: кадмий (Cd), хром (Cr), цинк (Zn). Обычно они обрабатывают валентности от +1 до +3, но такие элементы, как Chromium, обрабатывают валентности +2, +3, +6.
Редкие земли: лантаноиды и актиниды:
Их называют редкими землями из-за их малочисленности на планете. Они делятся на две группы: лантаноиды и актиниды. Они находятся на двух отдельных строках Периодической таблицы. Обычно они работают с валентностью +3 и имеют тенденцию образовывать гидроксиды. Наиболее важным элементом среди них является церий, который используется при получении пирофорных сплавов (Alloy Мишметалл, для камней для зажигалок), в газовых шлангах для освещения и при производстве специальных очков, поглощающих ультрафиолетовые лучи и тепловое излучение.
Наиболее мощные радиоактивные элементы, такие как уран (U) и плутоний (Pu), являются частью этих групп. которые, учитывая их нестабильность, высвобождают энергию и распадаются, теряя альфа-частицы (ядра Гелий). Позже они становятся менее нестабильными элементами, согласно радиоактивным сериям.