Шта је Електролиза
Хемија / / July 04, 2021
У хемији, Електролиза је појава у којој електрична струја пролази кроз водени раствор јонског једињења, и почиње усмери јоне (наелектрисане честице) једињења а две електроде, позитивно (Анода, привлачи негативно наелектрисане анионе) и негативне (Катода, привлачи позитивно наелектрисане катионе). Овом појавом управља закон електростатике који указује да се супротни набоји међусобно привлаче.
Електролити
1883. год. Мицхаел Фарадаи открио да водени раствори одређених супстанци проводе електричну струју, док раствори других супстанци не.
Да би тестирао да ли водени раствор проводи електричну струју, Фарадаи је дизајнирао једноставан апарат који се састоји од Коло једносмерне струје од 110 волти, Лампа, И две повезане металне или графитне електроде до тренутног извора.
Ако су електроде уроњене у воду, количина струје је толико мала да лампа не светли; исто важи и ако су умочени у раствор шећера.
Напротив, ако су уроњени у раствор Натријум хлорид НаЦл или од Хлороводонична киселина ХЦл, лампа сјајно свијетли, што доказује да
растварање је одличан проводник. С друге стране, коришћење сирћетне киселине ЦХ3Концентровани ЦООХ, раствор лоше води струју, али када се киселина разблажи водом Х2Или, његова електрична проводљивост се повећава.Током проласка струје кроз различита решења, на електродама се добијају различити производи.
Током студија о електролизи, Фарадаи је извео следеће законе:
1. закон: Количина супстанце која има своју хемијску трансформацију у електроди је пропорционална количини електричне енергије која пролази кроз раствор.
2. закон: Ако се иста количина електричне енергије пропушта кроз различита раствора, тежине супстанци разложени или таложени на различитим електродама пропорционални су еквивалентним тежинама поменутих супстанце.
Да наведемо пример:
Претпоставља се да имате пет различитих електролитичких ћелија. Први са Хлороводонична киселина ХЦл, други са Бакар сулфат ЦуСО4, трећи са Антимониоус Цхлориде СбЦл3, четврти са Станнов хлорид СнЦл2 а пети са Станниц Цхлориде СнЦл4.
Иста струја пролази кроз низ електролитичких ћелија, све док се не ослободи 1.008 грама водоника (а Еквивалентна тежина водоника) раствора хлороводоничне киселине, тежине (у грамима) осталих производа који су пуштени у исто време Су:
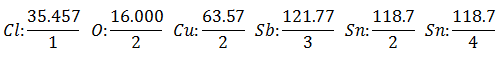
Тхе Тежина еквивалента има вредност од Атомска тежина елемента подељена са Валенсијом елемента.
Да бисте ослободили еквивалентну тежину било ког предмета, потребан вам је 96500 Куломи. Ова количина електричне енергије се назива 1 Фарадаи.
Фарадаи-ова јединица
Ампер је дефинисан као једнообразна струја која таложи 0,001118 грама сребра (Аг) из раствора сребрног нитрата (АгНО3) у секунди. Пошто је атомска тежина сребра 107,88 г / мол, однос 107,88 / 0,001118 даје број амперских секунди или кулона потребна струја да положи хемијски еквивалент сребра. Ова количина је 96494 Кулона (вредност 96500 је прилично приближна за једноставније прорачуне) и назива се 1 Фарадаи оф Елецтрицити.
Електроде
Фарадаи је звао Анода на позитивној електроди, а катода на негативној електроди. Такође је створио изразе Анион и Катион, који се примењују на супстанце које се појављују на аноди и на катоди током Електролизе.
Тренутно је друга дефиниција електрода:
Анода: Електрода у којој долази до губитка електрона или оксидације.
Катода: Електрода у којој долази до појаве или смањења електрона.
Електролити и не-електролити
Провођење електричне струје кроз растворе није било на задовољавајући начин објашњено све до 1887. године, када је Сванте Аррхениус објавио своју теорију. Пре него што смо увидели и разумели Аррениусову теорију, прво смо изложили неке чињенице које су науци биле познате када ју је Архениус формулисао:
Тхе Неелектролитна решења имају својства која се могу израчунати применом Раоултовог закона. Притисак паре и посматране тачке кључања и смрзавања ових раствора су практично исти као и израчунате вредности.
Тхе Раоултов закон објашњава да притисак паре сваке растворене супстанце у раствору зависи од сопствене молске фракције у њој, помножене са њеним притиском паре у чистом стању.

Раоултов закон пропада када се примењује на растворе електролита у води. Варијације притиска паре и тачака кључања и смрзавања су увек веће од оних предвиђених горе поменутим законом, и, штавише, повећавају се приликом разблаживања.
Таква одступања представљају вредност и, која је однос варијације уочене у тачки смрзавања између варијације израчунате у тачки смрзавања:

Вредност и је мера одступања од Раоултовог закона, која је једнака 1 када нема одступања.
Електрична проводљивост електролита
Аррхениус је истраживао проводљивост водених раствора електролита да би открио како варира проводљивост у зависности од концентрације електролита.
Измерила је моларну проводљивост (која је проводљивост која одговара једном молу раствореног електролита; односно специфична проводљивост која се односила на један мол и установила је да се повећавала разблаживањем.
Аррхениус је упоредио своје резултате са мерењима одступања од Раоултовог закона и открио блиску везу између њих и моларне проводљивости. У његовој теорији се објашњава понашање електролита:
„Молекули електролита се раздвајају на електрично наелектрисане честице зване јони. Растварање је непотпуно и постоји равнотежа између молекула и њихових јона. Јони проводе струју док се крећу унутар раствора “.
Одступања од Раоултовог закона настају услед повећања броја честица насталих делимичном дисоцијацијом молекула.
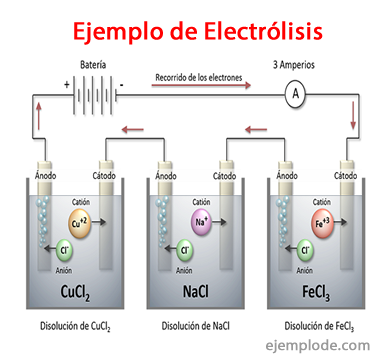
Примери електролизе
Нека решења која се понашају попут електролита, односно имају капацитет за електролизу су:
Натријум хлорид НаЦл
Хлороводонична киселина ХЦл
Натријум сулфат На2СВ4
Сумпорна киселина Х.2СВ4
Натријум хидроксид НаОХ
Амонијум хидроксид НХ4Ох
Натријум карбонат На2ЦО3
Натријум бикарбонат НаХЦО3
Азотна киселина ХНО3
Сребрни нитрат АгНО3
Цинков сулфат ЗнСО4



