แนวคิดในคำจำกัดความ ABC
เบ็ดเตล็ด / / April 22, 2022
นิยามแนวคิด
อะซีโอโทรปเป็นส่วนผสมของสารประกอบทางเคมีซึ่งมีองค์ประกอบที่กำหนด ซึ่งเดือดที่อุณหภูมิหนึ่ง ลักษณะพื้นฐานคือของผสมจะมีพฤติกรรมราวกับว่าเป็นสารบริสุทธิ์เพียงชนิดเดียว โดยคงคุณสมบัติไว้และให้การจัดการที่ง่าย

วิศวกรเคมี
ส่วนผสมสามารถให้โดยส่วนประกอบตั้งแต่สองส่วนประกอบขึ้นไปและ องค์ประกอบ มันเหมือนกันทั้งในเฟสของเหลวและในเฟสแก๊ส ซึ่งทำให้เกิดความคล้ายคลึงกันกับสารบริสุทธิ์ จากนี้สรุปได้ง่าย ๆ ว่าส่วนผสมนี้ไม่สามารถแยกออกเป็นส่วนประกอบโดยกระบวนการเช่น การกลั่นแบบเศษส่วนเนื่องจากตามที่กล่าวไว้ข้างต้นจะคงสัดส่วนไว้โดยทำตัวเหมือนเป็นโสด ส่วนประกอบ.
อีกลักษณะหนึ่งคือจุดเดือดของส่วนผสมนี้สามารถสูงขึ้น ต่ำลง หรือเท่ากับจุดเดือดของส่วนประกอบอย่างใดอย่างหนึ่ง เมื่อ azeotrope เดือดที่ a อุณหภูมิ ของการเดือดสูงสุด เรียกว่า อะซีโอโทรปสูงสุด และเมื่อเดือดที่อุณหภูมิต่ำสุดที่เป็นไปได้ จะเรียกว่า อะซีโอโทรปขั้นต่ำ ซึ่งหมายความว่าอะซีโอโทรปขั้นต่ำมีจุดเดือดต่ำกว่าส่วนประกอบบริสุทธิ์ และในทางกลับกันกับอะซีโอโทรปสูงสุด ตัวอย่างเช่น ในส่วนผสมของเมทานอล - เบนซิน อะซีโอโทรปมีค่าต่ำสุด (0.61 เบนซีน - 0.39 เมทานอลในเศษส่วน โมลาร์) ที่มีจุดเดือด 58 °C ในถังที่มีจุดเดือดของน้ำมันเบนซินอยู่ที่ 80 °C และของเมทานอล 65°C
อะซีโอโทรปขั้นต่ำและสูงสุด
ทีนี้… อะซีโอโทรปมาจากไหน? เมื่อมีการเบี่ยงเบนไปจาก กฎ Raoult นั่นคือความดันไอของส่วนผสม azeotropic ไม่เกี่ยวข้องโดยตรงกับเศษส่วนกรามของมัน เมื่อแนวคิดของส่วนผสม azeotropic เกิดขึ้น ความเบี่ยงเบนเหล่านี้เกิดขึ้นเมื่อส่วนประกอบดึงดูดหรือผลักกันอย่างมีนัยสำคัญ กล่าวคือ แรงระหว่างโมเลกุลมีความแตกต่างกันมากในสารประกอบต่างๆ
เมื่อค่าเบี่ยงเบนเป็นค่าบวก เรามีค่าอะซีโอโทรปขั้นต่ำ ในขณะที่ถ้าค่าเบี่ยงเบนเป็นค่าลบ เราก็มีค่าอะซีโอโทรปสูงสุด เพื่อให้เข้าใจแนวคิดนี้มากขึ้น มาดูกราฟิกกัน:
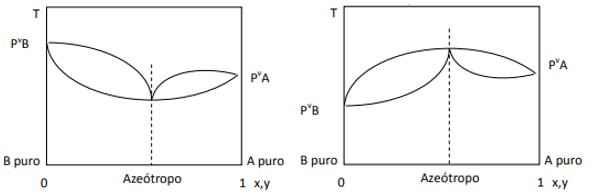
ในที่นี้เราสังเกตว่า ถ้าส่วนผสมนั้นอยู่ในอุดมคติ ตามกฎของราอูลต์ ความดันไอของส่วนประกอบบริสุทธิ์ควรต่อกันเป็นเส้นตรง เนื่องจาก ก็มีความเบี่ยงเบนไปจากกฎนั้นที่ก่อให้เกิดการก่อตัวของอะซีโอโทรปต่ำสุดและสูงสุด ขึ้นอยู่กับว่ามีความเกี่ยวข้องกันมากหรือน้อยระหว่าง ส่วนประกอบ เมื่อส่วนเบี่ยงเบนกฎของราอูลท์เป็นลบ ดังรูปทางซ้าย มีค่าต่ำสุดที่ ไดอะแกรม ของความดัน แต่สูงสุดในแผนภาพอุณหภูมิ (ดังนั้น azeotrope ของค่าสูงสุด) ในทางกลับกัน หากค่าเบี่ยงเบนเป็นบวกต่อกฎของ Raoult ก็จะเป็นค่าสูงสุดในความกดดันเทียบกับ องค์ประกอบ แต่ขั้นต่ำในแผนภาพอุณหภูมิเทียบกับ องค์ประกอบ (ที่นี่เรามี azeotrope ขั้นต่ำ) อย่าสับสนระหว่างแรงดันกับไดอะแกรม องค์ประกอบและอุณหภูมิเทียบกับ องค์ประกอบ.
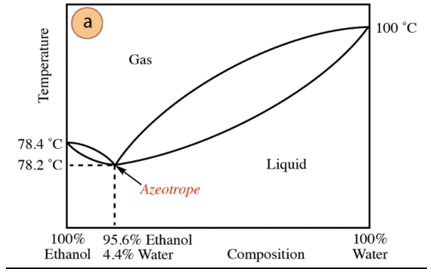
ในกรณีของส่วนผสมระหว่างเอทานอลกับน้ำ มีอะซีโอโทรปขั้นต่ำที่มีองค์ประกอบคือเอทานอล 95.6% และน้ำ 4.4% อุณหภูมิเดือดของส่วนผสมอะซีโอโทรปิกต่ำกว่าส่วนประกอบบริสุทธิ์ 78.2 °C ดังนั้น สมมติว่ากลั่นส่วนผสมของน้ำกับเอทานอลที่มีปริมาณน้ำสูง (ใกล้ถึง 100%) จะไม่สามารถรับแอลกอฮอล์บริสุทธิ์ได้ เนื่องจากจะได้เศษส่วนที่มากกว่าในแต่ละขั้นตอนการกลั่น ของเอทานอลแต่ไม่ถึง 100% จะค่อยๆเข้าใกล้องค์ประกอบของส่วนผสม azeotropic (จุดต่ำสุด ภายใต้). นั่นคือเหตุผลที่เช่นเดียวกับน้ำ มันมีแนวโน้มที่จะก่อตัวเป็นอะซีโอโทรปขั้นต่ำด้วย สารประกอบอินทรีย์ (ตามประเภทของแรงระหว่างโมเลกุลที่ทำปฏิกิริยา) ก่อนหน้านี้จำเป็นต้องเอาน้ำออกจากส่วนผสมเพื่อให้ได้สารประกอบบริสุทธิ์ หรือเมื่อได้อะซีโอโทรปแล้ว วิธีการของ การสกัด ของน้ำเพิ่มเติม
จากที่กล่าวไปข้างต้น หาเครื่องดื่มแอลกอฮอล์ไม่ได้โดยบังเอิญ (ในซูเปอร์มาร์เก็ตและ ร้านขายยา) ที่ 95% เป็นสินค้าที่ถูกที่สุดที่หาได้ เพื่อให้ได้แอลกอฮอล์บริสุทธิ์ จำเป็นต้อง "ทำลาย" อะซีโอโทรปด้วย เทคนิค เพิ่มเติม เช่น การใช้สารทำให้แห้งหรือการกลั่นด้วยอะซีโอทรอปิก การกลั่นแบบอะซีโอทรอปิกประกอบด้วยการเพิ่มส่วนประกอบพิเศษลงในส่วนผสมที่ทำหน้าที่โดยการกักขังและโดย ปฏิสัมพันธ์ ด้วยส่วนประกอบใดๆ ของของผสม (ค่าสัมพรรคภาพที่สูงขึ้น) สามารถลบออกจากส่วนผสมได้
หัวข้อใน Azeotropes

