100 eksempler på kemiske elementer
Miscellanea / / November 13, 2021
Det kemiske grundstoffer er en type sag, der uden procedure eller kemisk reaktion de kan reduceres eller nedbrydes til andre enklere elementer. Af denne grund kan det siges, at et element er alt stof lavet af atomer af den samme og unikke klasse, det vil sige atomer, der har samme atomnummer (lige antal protoner), skønt de har forskellig atommasse. For eksempel: svovl, bor, krom, tin.
Den første definition af et kemisk element blev introduceret af Lavoisier i Traité Élémentaire de Chimiei 1789. Tilbage i det 18. århundrede opdelte Lavoisier enkle stoffer i fire grupper:
Periodisk tabel over elementer
I dag kender de hinanden 118 kemiske grundstoffer. De er alle samlet, klassificeret og organiseret efter mange af deres ejendomme i et grafisk skema kendt som det periodiske system for elementerne, som oprindeligt blev oprettet af den russiske kemiker Dimitri Mendeleyev i 1869. Det periodiske system består af 18 grupper (kolonner) og 7 perioder (rækker), hvori de kemiske grundstoffer er placeret.
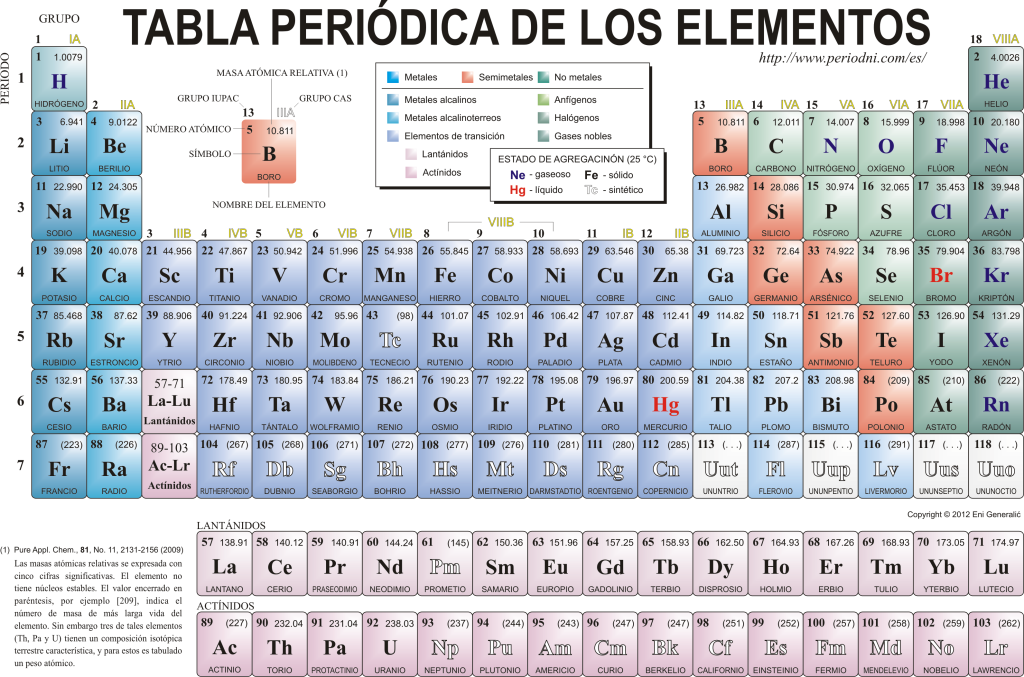
Det hovedgrupper der kan findes i denne tabel er:
Alkalimetaller (gruppe 1), jordalkalimetaller (gruppe 2), scandiumfamilien, som inkluderer jordarter og actinider (gruppe 3), titanfamilien (Gruppe 4), vanadiumfamilien (gruppe 5), chromfamilien (gruppe 6), manganfamilien (gruppe 7), jernfamilien (gruppe 8), koboltfamilien (gruppe 9), nikkelfamilien (gruppe 10), kobberfamilien (gruppe 11), zinkfamilien (gruppe 12), jordelementer (gruppe 13), kulstofelementer, i denne gruppe er Kulstof, som er grundlaget for livet på jorden (gruppe 14), kvælstofdannende grundstoffer (gruppe 15), amfigenetiske elementer, inkluderer ilt, et grundlæggende element for det vejrtrækning af levende væsner (Gruppe 16), halogenelementer (Gruppe 17) og ædelgasser (Gruppe 18).
Mange af disse elementer har stabile eller radioaktive isotoperdet vil sige, at det samme kemiske element, for eksempel hydrogen (H), kan have flere isotoper (1H, 2H, 3H). Dette betyder, at hvert isotopatom har det samme antal protoner (hvilket indebærer, at det hører til det samme kemiske element) og et andet antal neutroner.
Nogle isotoper er ikke stabile (radioaktive), dvs. opløses på en bestemt tid udsender visse partikler (blandt andet neutroner, fotoner, alfapartikler) og genererer andre stabile eller radioaktive isotoper. Kemiske grundstoffer har egenskaber som f.eks kogende og den af fusion, elektronegativitet, massefylde og ionisk radius, blandt andre. Disse egenskaber er vigtige, fordi de giver os mulighed for at forudsige dens adfærd, reaktivitet osv.
Hvordan præsenteres elementerne i det periodiske system?
Hvert kemisk element er karakteriseret i Periodiske system ved hjælp af en vis symbologi. For det første i midten af hver firkant dens universelle symbol, der består af en eller to bogstaver (efter konvention, hvis der er to bogstaver, er den første skrevet med store bogstaver og den næste med små bogstaver).
Over og til venstre vises i lille skrift su Atom nummer, som er den, der angiver mængden af protoner, som dette element har. Under elementssymbolet vises navnet og over til venstre vises navnet. atommasse i forhold. Derudover betyder farven, i hvilken elementssymbolet er repræsenteret, dets aggregeringstilstand (i henhold til den repræsentation, der anvendes i hvert periodisk system).
De forskellige elementer til stede atomare radier variabler, og når antallet af protoner i kernen stiger, jo større er den tiltrækningskraft, som kernen udøver på elektronerne, så atomradien har en tendens til at falde. Når atomradiusen er lille, er elektronerne i skyens yderste niveau meget tiltrukket af kernen, så de giver ikke let op. Det modsatte sker med elementer med høje atomare radier: de giver let deres ydre elektroner op.
Således stiger atomradius fra top til bund, når vi går gennem grupperne i det periodiske system og falder fra venstre mod højre, når vi går gennem deres perioder.
Eksempler på kemiske grundstoffer
| Kemisk element | Symbol |
| Actinium | Ac |
| Aluminium | Til |
| Americium | ER |
| Antimon | Sb |
| Argon | Ar |
| Arsen | Es |
| Astat | På |
| Svovl | S |
| Barium | Ba |
| Beryllium | Være |
| Berkelium | Bk |
| Vismut | Bi |
| Bohrio | Bh |
| Bor | B |
| Brom | Br |
| Cadmium | CD |
| Kalk | AC |
| Californium | Jf |
| Kulstof | C |
| Cerium | EF |
| Cæsium | Cs |
| Klor | Cl |
| Kobolt | Co |
| Kobber | Cu |
| Chrome | Cr |
| Curium | Cm |
| Darmstadio | Ds |
| Dysprosium | D y |
| Dubnium | Db |
| Einsteinium | det er |
| Erbium | Er |
| Scandium | Sc |
| Tin | Sn |
| Strontium | Hr |
| Europium | Eu |
| Fermium | Fm |
| Fluor | F |
| Match | P |
| Francius | Fr |
| Gadolinium | Gd |
| Gallium | Ga |
| Germanium | Ge |
| Hafnium | Hf |
| Hassio | Hs |
| Helium | jeg har |
| Brint | H |
| Jern | Tro |
| Holmium | Ho |
| Indisk | I |
| Jod | jeg |
| Iridium | At gå |
| Ytterbium | Yb |
| Yttrium | Y |
| Krypton | Kr |
| Lanthanum | Det |
| Lawrencio | Lr |
| Lithium | Li |
| Lutetium | Man |
| Magnesium | Mg |
| Mangan | Mn |
| Meitnerius | Mt |
| Mendelevium | Md |
| Kviksølv | Hg |
| Molybdæn | Mo |
| Neodym | Na |
| Neon | Ne |
| Neptunium | Np |
| Niob | Nb |
| Nikkel | Ingen af dem |
| Kvælstof | N |
| Nobelio | Ikke |
| Guld | Au |
| Osmium | Du |
| Ilt | ELLER |
| Palladium | P.S |
| Sølv | Ag |
| Platin | Pt |
| At føre | Pb |
| Plutonium | Pu |
| Polonium | Po |
| Kalium | K |
| Praseodym | Pr |
| Løfte | Om eftermiddagen |
| Protactinium | Pa |
| Radio | Ra |
| Radon | Rn |
| Rhenium | Re |
| Rhodium | Rh |
| Rubidium | Rb |
| Ruthenium | Ru |
| Rutherfordio | Rf |
| Samarium | Ye |
| Seaborgio | Sg |
| Selen | Jeg ved |
| Silicium | Ja |
| Natrium | Na |
| Thallium | Tl |
| Tantal | Ta |
| Technetium | Tc |
| Tellurium | Te |
| Terbium | TB |
| Titanium | Du |
| Thorium | Th |
| Thulium | Tm |
| Copernicus | Cn |
| Livermorio | Lv |
| Roentgenio | Rg |
| Ununoctium | Uuo |
| Ununpentium | Uup |
| Flerovio | Fl |
| Ununseptio | Uus |
| Ununtrium | Uut |
| Uran | ELLER |
| Vanadium | V |
| Wolfram | W |
| Xenon | Xe |
| Zink | Zn |
| Zirkonium | Zr |

Følg med:

